Méthane

Multi tool use
| Méthane | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Structure de la molécule de méthane. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Nom UICPA |
méthane |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Synonymes |
hydrure de méthyle |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
No CAS |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NoECHA |
100.000.739 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
No EC |
200-812-7 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
PubChem |
297 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
SMILES |
C , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
InChI |
InChI : InChI=1/CH4/h1H4 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence |
gaz comprimé ou liquéfié, incolore et inodore[1] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Formule brute |
CH4 [Isomères] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Masse molaire[2] |
16,0425 ± 0,0011 g/mol C 74,87 %, H 25,13 %, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
T° fusion |
−182,47 °C[3] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
T° ébullition |
−161,52 °C[3] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Solubilité |
22 mg·l-1 (eau, 25 °C)[4] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Paramètre de solubilité δ |
11,0 MPa1/2 (25 °C)[5] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Masse volumique |
422,62 kg·m-3 (−161 °C, liquide) 0,6709 kg·m-3 (15 °C, 1 bar, gaz)[3] équation[6] : ρ=2.9214/0.28976(1+(1−T/190.56)0.28881){displaystyle rho =2.9214/0.28976^{(1+(1-T/190.56)^{0.28881})}}
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
T° d'auto-inflammation |
537 °C[1] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Point d’éclair |
Gaz Inflammable[1] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Limites d’explosivité dans l’air |
4,4–17 %vol[3] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Pression de vapeur saturante |
2 atm (−152,3 °C); 5 atm (−138,3 °C); équation[6] : Pvs=exp(39.205+−1324.4T+(−3.4366)×ln(T)+(3.1019E−5)×T2){displaystyle P_{vs}=exp(39.205+{frac {-1324.4}{T}}+(-3.4366)times ln(T)+(3.1019E-5)times T^{2})}
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Point critique |
4 600 kPa[7], −82,6 °C[8] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vitesse du son |
1 337 m·s-1 (liquide, −161,5 °C) 450 m·s-1 (gaz, 27 °C, 1 atm)[9] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ΔfH0gaz |
-74,87 kJ·mol-1[10] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cp |
équation[11] : CP=(34.942)+(−3.9957E−2)×T+(1.9184E−4)×T2+(−1.5303E−7)×T3+(3.9321E−11)×T4{displaystyle C_{P}=(34.942)+(-3.9957E-2)times T+(1.9184E-4)times T^{2}+(-1.5303E-7)times T^{3}+(3.9321E-11)times T^{4}}
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
PCS |
890,8 kJ·mol-1[12] (25 °C, gaz) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
PCI |
803,3 kJ·mol-1[13] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés électroniques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1re énergie d'ionisation |
12,61 ± 0,01 eV (gaz)[14] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
SGH[16] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Danger H220, H220 : Gaz extrêmement inflammable |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
SIMDUT[17] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  A, B1, A : Gaz comprimé température critique = −82,62 °C B1 : Gaz inflammable limite inférieure d'inflammabilité = 5,0 % Divulgation à 1,0 % selon les critères de classification |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Code Kemler : 23 : gaz inflammable Numéro ONU : 1971 : GAZ NATUREL (à haute teneur en méthane) COMPRIMÉ ; ou MÉTHANE COMPRIMÉ Classe : 2.1 Étiquette :  2.1 : Gaz inflammables (correspond aux groupes désignés par un F majuscule);
Code Kemler : 223 : gaz liquéfié réfrigéré, inflammable Numéro ONU : 1972 : GAZ NATUREL (à haute teneur en méthane) LIQUIDE RÉFRIGÉRÉ ; ou MÉTHANE LIQUIDE RÉFRIGÉRÉ Classe : 2.1 Étiquette :  2.1 : Gaz inflammables (correspond aux groupes désignés par un F majuscule); |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Écotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
LogP |
1,09[1] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
modifier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le méthane est un composé chimique de formule chimique CH4 découvert et isolé par Alessandro Volta entre 1776 et 1778. C'est l'hydrocarbure le plus simple, et le premier terme de la famille des alcanes. Parce qu'assez abondant dans le milieu naturel, c'est un combustible à fort potentiel. Sa combustion dans le dioxygène pur produit du dioxyde de carbone CO2 et de l'eau H2O avec une importante libération d'énergie :
- CH4 + 2 O2 → CO2 + 2 H2O : ΔH = −891 kJ mol−1.
Gazeux aux conditions normales de température et de pression il peut être transporté sous cette forme (gazeuse) généralement par gazoduc, ou à l'état liquéfié par méthaniers et plus rarement par camions.
Les archées dites méthanogènes produisent de façon anaérobie pratiquement tout le méthane gardé dans les terrains sédimentaires. Le méthane produit par la réaction de serpentinisation entre les péridotites et l'eau de mer dans les dorsales océaniques s'échappe normalement et est oxydé dans l'atmosphère.
D'énormes quantités de méthane sont enfouies dans le sous-sol géologique sous forme de gaz naturel. De grandes quantités, difficiles à évaluer, sont également présentes sur le plancher océanique sous forme d'hydrates de méthane, stables à basse température et haute pression. Les volcans de boue, les décharges publiques et la digestion du bétail, notamment des ruminants dégagent du méthane.
Il est naturellement présent dans l'atmosphère terrestre, mais les apports anthropiques ont plus que doublé sa concentration depuis la révolution industrielle. Elle atteignait 1 748 ppb en 1998[18]. Après une période de stabilisation, la croissance de sa concentration a repris en 2007 et a connu un nouveau record en 2016 (1 853 ppb, soit + 257 % par rapport au niveau préindustriel)[19].
Il persiste moins de dix ans dans l'atmosphère où il est détruit par des radicaux hydroxyle OH–, mais c'est un gaz à effet de serre bien plus puissant que le CO2, responsable, au niveau actuel de sa concentration, de quelques pour cent de l'effet de serre total à l'œuvre dans notre atmosphère[20]. Ainsi, à titre comparatif, sur un horizon de 100 ans, relâcher une certaine quantité de méthane dans l'atmosphère a un effet sur le réchauffement climatique environ 9 fois plus important que de brûler cette même quantité de méthane en dioxyde de carbone (CO2)[21].
Sommaire
1 Histoire
2 Formation, stockages naturels
2.1 Le méthane de la surface et du sous-sol
2.2 Le méthane des fonds marins
3 Propriétés physico-chimiques
3.1 Solubilité du méthane dans l'eau
3.2 Dégazage spontané
3.3 Inflammation et combustion
4 Dans l'Univers
4.1 Dans les nuages interstellaires
4.2 Sur Titan
4.3 Sur Mars
4.4 Sur les planètes géantes
5 Utilisation
5.1 Biocarburant de troisième génération
5.2 Stockage énergétique
6 Environnement : contribution à l'effet de serre
6.1 Un gaz à effet de serre
6.2 Méthane et ozone
6.3 Variation historique (depuis l'Empire romain)
6.4 Variations récentes de teneur de l'air
6.5 Origine des émissions
6.6 Puits de méthane
7 Réduire les émissions de méthane
8 Vers une synthèse photocatalytique du méthane ?
9 Biosynthèse du méthane
10 Méthane et biodiversité
11 Notes et références
11.1 Notes
11.2 Références
12 Voir aussi
12.1 Bibliographie
12.2 Articles connexes
Histoire |
Alessandro Volta découvre le méthane en 1776 en étudiant le « gaz inflammable des marais » de l'îlet Partegora, qui s'échappait de zones humides proches de sa maison[22]. Il en prélève des capsules issues du sédiment du Lac Majeur[23] et en isola la fraction inflammable[24] dont il comprend qu'il est issu de la putréfaction des plantes[25].
En 1910, Söhngen écrivait que le méthane se forme de façon si considérable aux Pays-Bas « qu'en différents lieux on s'en sert pour l'éclairage et le chauffage de fermes et de maisons »[25].
C'est à cause du grisou (essentiellement constitué de méthane), responsable jusqu'à nos jours de nombreuses catastrophes minières, que sont mises au point les lampes de sûreté dans les mines de charbon, et notamment la lampe de Davy (1817).
L'impact du méthane sur le climat est inconnu, puis suspecté jusqu'en 1976 où l'on démontre que le méthane est un puissant gaz à effet de serre.
Ce n'est qu’avec l'exploration spatiale qu'on découvre l'omniprésence du méthane dans l'Univers.
Formation, stockages naturels |
Le méthane de la surface et du sous-sol |
Le méthane est le principal constituant du biogaz issu de la fermentation de matières organiques animales ou végétales en l'absence d'oxygène. Il est fabriqué par des archées méthanogènes qui vivent dans des milieux anaérobies c'est-à-dire sans oxygène[26].
Le méthane est ainsi le seul hydrocarbure classique qui peut être obtenu rapidement et facilement grâce à un processus biologique naturel. Nous utilisons principalement du gaz naturel et donc du méthane fossile, mais l'utilisation du méthane renouvelable, aussi appelé biogaz, est en plein développement (Suède, Allemagne, Danemark, Viêt Nam, Cambodge, Chine, Inde, etc.).
Le méthane se dégage naturellement des zones humides peu oxygénées comme les marais et certains sols longuement inondés (mais dans ces milieux il peut aussi exister des organismes méthanotrophes qui en consomment une partie)[27]. Le CH4 se forme aussi dans l'estomac et le tube digestif de nombreux animaux (de certains invertébrés jusqu'aux mammifères, herbivores principalement). Ce gaz est également présent en faible quantité dans les gaz intestinaux humains[28].
Le méthane des fonds marins |
Des quantités importantes de méthane sont piégées sous forme d'hydrates de méthane (clathrates) au fond des océans (où leur exploitation est envisagée) et dans les pergélisols. Ces deux réservoirs pourraient jouer un rôle important dans les cycles climatiques et, les dernières observations d'une équipe d'océanographes le confirment, ils commencent à perdre une quantité croissante de méthane dans l'atmosphère[29].
Le débullage de méthane à partir des sédiments marins, sur les lignes de fractures du plancher océanique, est considéré comme un indice de risque sismique élevé, voire comme un possible précurseur des tremblements de terre (sous réserve de confirmation à la suite des expériences en cours, en mer de Marmara, sur la faille nord-anatolienne au large de la Turquie)[30].
Un documentaire nommé « Méthane, rêve ou cauchemar » sur Arte (2014)[31], fait état de la découverte que le méthane issu des planchers océaniques, à une profondeur minimale de 400 m, est presque totalement absorbé par des bactéries avant d'atteindre une remontée de 200 m. L'accident de la plateforme de Deepwater Horizon, survenu dans le golfe du Mexique, a libéré une très grande quantité de méthane sur le plancher océanique dont aucune trace ne subsistait après six mois, un temps considéré comme très court au regard de la quantité de méthane s'étant échappé du puits d'extraction endommagé. Le fait que le méthane ait été absorbé par des micro-organismes n'implique pas pour autant que l'incident n'ait pas de conséquence pour l'environnement, en particulier à cause de l'acidification de l'océan qui en résulte.
Propriétés physico-chimiques |
Dans les conditions normales de température et de pression, le méthane est un gaz incolore et inodore. Environ deux fois plus léger que l'air, il est explosif en milieu confiné (grisou). En milieu non confiné il se dilue dans l'air et s'échappe vers la haute atmosphère, où il a moins tendance à former des nuages explosifs que les gaz plus lourds que l'air (propane, butane) ; par contre c'est un puissant gaz à effet de serre.
Solubilité du méthane dans l'eau |
Elle dépend beaucoup de la température et de la pression (il diminue avec l'une et augmente avec l'autre). Ainsi le grisou minier peut être en partie solubilisé et transporté par de l'eau (qui contient alors aussi du radon ainsi que du dioxyde de carbone et du dioxyde de soufre qui l'acidifient). Selon l'Ineris une eau à 10 °C initialement saturée en gaz de mine sous une pression de 10 bars (équivalente à 100 m de charge hydraulique), va perdre lors de sa détente environ 0,5 m3 de méthane et 12 m3 de CO2 par m3 d'eau[32].
Dégazage spontané |
Les hydrates de méthanes immergés fondent en libérant des chapelets de bulles. De même les micropoches de méthane produites par les bactéries du sédiment se libèrent en formant des bulles qui remontent dans la colonne d'eau, notamment dans la tourbe (où le phénomène est difficile à suivre[33]) et les vases estuariennes[34], et plus ou moins vite selon la teneur en matière organique[35] et la porosité/viscosité du substrat[36],[37]. ce bullage représentant dans les zones humides une fraction importante et probablement sous-estimée[38] des émissions de méthane et de gaz à effet de serre. Des chambres à flux[39] automatisées fonctionnant en continu ont été combinées à un spectroscope pour mieux quantifier ces bulles et leur teneur en CH4.
A titre d'exemple : dans un milieu pauvre de zone tempérée, en 2009), le bullage variait d’une heure à l’autre, avec un pic nocturne de libération (de 20h00 à 06h00, heure locale) bien que les flux stables (c’est-à-dire ceux avec une augmentation linéaire de la concentration de CH4 dans l’espace de tête de la chambre) ne présentaient pas de variabilité quotidienne. Les taux de bullage moyens saisonniers ont culminé à 843,5 ± 384,2 "événements" par mètre carré et par jour en été, avec en moyenne 0,19 mg de CH4 rejetée par "événement".
Il est aussi démontré que la flore des marais (y compris salée) influe sur la quantité de méthane saisonnièrement libérée dans l'air ou l'eau (avec par exemple Carex rostrata[40]. Les dates et l'importance des inondations ou des sècheresses jouent aussi[41]
Inflammation et combustion |
Le méthane est un combustible qui compose jusqu'à 90 % le gaz naturel.
Son point d'auto-inflammation dans l'air est de 540 °C[42]. La réaction de combustion du méthane s'écrit :
- CH4 + 2 O2 → CO2 + 2 H2O.
- La combustion du méthane à 25 °C libère une énergie de 39,77 MJ/m3 (55,53 MJ/kg)[a], soit 11,05 kWh/m3 (15,42 kWh/kg)[b].
- Le gaz naturel, (constitué à plus de 90 % de méthane) est transporté par navires (méthaniers) à une température de −162 °C et à une pression voisine de la pression atmosphérique. Les réservoirs sont construits sur le principe de la bouteille isotherme et leur capacité peut aller jusqu'à 200 000 m3 de gaz liquide par réservoir. Un méthanier comportant plusieurs réservoirs, sa cargaison peut actuellement atteindre 154 000 m3 de GNL, Gaz Naturel Liquéfié. Les futurs méthaniers pourront transporter jusqu'à 260 000 m3 de GNL. Le volume du méthane à l'état gazeux est égal à 600 fois son volume à l'état liquide, à pression atmosphérique.
- Présent à tous les stades de l'industrie pétrolière, mais mal valorisé, il est fréquemment brûlé en torchère, ce contribue à l'effet de serre (les pétroliers restreignent donc ce procédé).
Dans l'Univers |
Dans les nuages interstellaires |
Du méthane a été retrouvé à l'état de traces dans plusieurs nuages interstellaires.
Sur Titan |
Le méthane est présent partout sur Titan, et même à l'état liquide sous forme de lacs, de rivières, et de mers, particulièrement près du pôle nord de l'astre. Sa présence en a été établie dès 1944. Au point que la chaleur dégagée par la sonde Huygens, lors de l'impact du 14 janvier 2005 a provoqué un notable dégagement de méthane gazeux.
L'atmosphère de Titan, satellite de Saturne, est principalement constituée d'azote avec une proportion de méthane allant de 1,4 % dans la stratosphère jusqu'à 4,9 % au niveau du sol. Il ne pleuvait pas lorsque la sonde Huygens s'est posée sur Titan, mais l'ESA n'exclut pas que des averses de méthane y soient fréquentes. Simplement, l'aridité du sol absorberait rapidement ces précipitations, à la manière des déserts terrestres.
Sur Mars |
L'un des résultats les plus étonnants de la sonde spatiale Mars Reconnaissance Orbiter, en orbite autour de Mars depuis le 10 mars 2006, provient de l'étude détaillée en 2008 de la région de Nili Fossae, identifiée début 2009 comme source d'importants dégagements de méthane[43]. Ce gaz a été détecté dès 2003 dans l'atmosphère de Mars, aussi bien par des sondes telles que Mars Express que depuis la Terre ; ces émissions de CH4 se concentreraient notamment en trois zones particulières de la région de Syrtis Major Planum[44]. Or le méthane est instable dans l'atmosphère martienne, des études récentes suggérant même qu'il soit six cents fois moins stable qu'estimé initialement (on évaluait sa durée de vie moyenne à 300 ans) car le taux de méthane n'a pas le temps de s'uniformiser dans l'atmosphère et demeure concentré autour de ses zones d'émission, ce qui correspondrait à une durée de vie de quelques centaines de jours ; la source de méthane correspondante serait par ailleurs 600 fois plus puissante qu'estimé initialement, émettant ce gaz une soixantaine de jours par année martienne, à la fin de l'été de l'hémisphère nord[45].
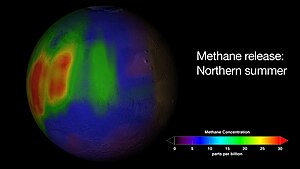
Visualisation d'un dégagement de méthane dans l'atmosphère de Mars début 2009, pendant l'été de l'hémisphère nord martien[46].
Les analyses géologiques menées en 2008 par la sonde Mars Reconnaissance Orbiter dans la région de Nili Fossae ont révélé la présence d'argiles ferromagnésiennes (smectites), d'olivine (silicate ferromagnésien (Mg,Fe)2SiO4, détectée dès 2003[47]) et de magnésite (carbonate de magnésium MgCO3)[48], ainsi que de serpentine[49]. La présence simultanée de ces minéraux permet d'expliquer assez simplement la formation de méthane, car, sur Terre, du méthane CH4 se forme en présence de carbonates — tels que le MgCO3 détecté dans la région en 2008 — et d'eau liquide lors du métamorphisme hydrothermal d'oxyde de fer(III) Fe2O3 ou d'olivine (Mg,Fe)2SiO4 en serpentine (Mg,Fe)3Si2O5(OH)4, particulièrement lorsque le taux de magnésium dans l'olivine n'est pas trop élevé et lorsque la pression partielle de dioxyde de carbone CO2 est insuffisante pour conduire à la formation de talc Mg3Si4O10(OH)2 mais aboutit au contraire à la formation de serpentine et de magnétite Fe3O4, comme dans la réaction :
- 12/x Mg2-xFexSiO4 + 2+(8(2-x)/x) H2O + CO2 → 4(2-x)/x Mg3Si2O5(OH)4 + (8x-4)xSiO2 + 4 Fe3O4 + CH4.
La probabilité de ce type de réactions dans la région de Nili Fossae est renforcée par la nature volcanique de Syrtis Major Planum et par l'étroite corrélation, observée dès 2004, entre le taux d'humidité d'une région et la concentration de méthane dans l'atmosphère[50].
Le méthane détecté par Curiosity lors d'une trentaine d'analyses de l’atmosphère n'est présent qu'à l'état de traces (0,4 parties par milliard (ppb), à comparer aux 1800 ppb de la Terre), mais sa fluctuation saisonnière (passage de 0,3 à 0,7 ppb) intrigue, car elle est trois fois plus importantes que ce que prévoient les théories disponibles[51]. Elle pourrait éventuellement être l'indice d’une présence de vie microbienne (actuelle ou fossile) et/ou résulter d'une ou plusieurs source(s) abiotique(s) : réaction d'eaux chaudes avec des olivines (évoquées plus haut), attaque par des UV solaires de météoroïdes et poussières stellaires riches en carbone minéral (car deux pics saisonniers se sont produits environ 15 jours après une pluie de météores martiens), désorption à partir d’une roche dont les pores ou feuillets s’ouvrent en été quand il fait plus chaud ; ou peut être ne s’agit il que d’une augmentation relative (ce serait le CO2 qui gelant en hiver aux pôles diminuerait dans l'atmosphère en donnant l’impression qu’il y a plus de méthane à ce moment, mais le phénomène devrait alors être plus marqué en plein hiver martien, à moins que des courants aériens n’apporte en fin d’été ce méthane jusqu’à l’emplacement de Curiosity)... Le débat est en cours[51].
Sur les planètes géantes |

Bandes de méthane dans l'atmosphère de Saturne.
On trouve également du méthane sous forme de nuages et de brume sur Uranus et Neptune, de gaz non condensé dans les atmosphères de Jupiter et de Saturne ; ainsi que peut-être sur les exoplanètes Epsilon Eridani c et Fomalhaut b.
Utilisation |
Les gisements fossiles de gaz naturel comportent entre 50 et 60 % de méthane, le gaz naturel brut est épuré avant d'être injecté sur le réseau de distribution.
La proportion de méthane présent dans le gaz naturel que nous utilisons est supérieure à 90 % dans la plupart des gaz.
Le méthane « biologique » ou biogénique, ou biogaz, qui est produit par la fermentation anaérobie de matière organique comporte 50 à 80 % de méthane, (60-65 % généralement)
Le biogaz produit dans les décharges pourrait être (bien davantage) récupéré et valorisé sous forme d'électricité, de chaleur ou comme carburant automobile. Pour l'instant, seules quelques expériences isolées (dans des fermes, des déchèteries…) ont vu le jour, spécialement dans les régions les plus froides (nord de l'Allemagne, de la France, Scandinavie, etc.), mais la rentabilité économique de ces installations est loin d'être acquise.[réf. nécessaire] (voir l'expérience en prison rwandaise).
Le méthane est valorisable comme combustible mais d'autres usages en seraient possibles. Par exemple, des chercheurs ont réussi à transformer à température presque ambiante (40 °C) du méthane en un ester (propionate d’éthyle) potentiellement valorisable. Pour ce faire, un carbène (composé très réactif) a été introduit dans une liaison du méthane via un catalyseur organométallique[52].
Biocarburant de troisième génération |
Pour produire un méthane de décharge assez pur et pour faire un bon biocarburant de troisième génération, un « digesteur anaérobie » inspiré de la digestion anaérobie à l'œuvre dans la panse des bovins est expérimenté au Canada. Des microorganismes méthanogènes vivant en symbiose avec les vaches savent produire plus de méthane que de CO2, mais ils ont des exigences précises, en température et humidité notamment. La difficulté est de conserver les conditions de vies optimales de ces organismes dans un milieu constitué de déchets, ce qu'on tente ici de faire au moyen d'électrodes spéciales régulant la température du milieu. Ce sont ensuite des fibres creuses constituées d'une membrane perméable qui devraient séparer le CO2 du méthane qui pourra ensuite être brûlé comme source d'énergie, utilisé par la carbochimie ou compressé et stocké[53].
Stockage énergétique |
Dans la perspective d'une transition vers des énergies renouvelables, des chercheurs de l'entreprise autrichienne Solar Fuel Technology (Salzbourg), en coopération avec l'Institut Fraunhofer de recherche sur l'énergie éolienne de Leipzig (IWES), le Centre de recherche sur l'énergie solaire et l'hydrogène de Stuttgart (ZSW) et l'université de Linz ont mis au point une solution de stockage de l'énergie sous forme de méthane[54],[55]. L'énergie électrique excédentaire d'origine éolienne ou photovoltaïque est utilisée pour décomposer de l'eau en dihydrogène et dioxygène (électrolyse de l'eau), puis le dihydrogène est combiné avec du dioxyde de carbone par une réaction de méthanation (réaction de Sabatier).
L'un des principaux intérêts de ce procédé est d'utiliser les infrastructures (réservoirs et conduites de gaz) existantes, dont la capacité de stockage serait suffisante pour couvrir les besoins de méthane de l'Allemagne pendant plusieurs mois, par exemple pendant[56] une période où le solaire et l'éolien ne peuvent couvrir les besoins énergétiques.
Environnement : contribution à l'effet de serre |
Un gaz à effet de serre |
Le méthane est un gaz à effet de serre qui contribue au réchauffement climatique, pris en compte en tant que tel par la directive 2003/87/CE. Il absorbe une partie du rayonnement infrarouge émis par la Terre, et l'empêche ainsi de s'échapper vers l'espace.
De plus il contribue aussi indirectement à l'effet de serre en diminuant la capacité de l'atmosphère à oxyder d'autres gaz à effet de serre (comme les fréons). Son utilisation comme combustible émet du CO2 à hauteur de 380 Mt/an (les émissions industrielles avoisinent 6 000 Mt/an).
L'influence du méthane sur le climat est moins importante que celle du dioxyde de carbone mais est quand même préoccupante. L'un des principaux enseignements du 5e rapport du GIEC en 2013 est que l'influence du méthane a longtemps été sous-estimée, son potentiel de réchauffement global (PRG) à cent ans passant de 21 dans le cadre du protocole de Kyoto, à 28 et même 34 en prenant en compte les rétroactions climatiques dans le dernier rapport du GIEC[57].
Le méthane est le deuxième gaz responsable du dérèglement climatique[58] (forçage radiatif de 0,97 W/m2 en 2011) derrière le CO2 (1,68 W/m2) mais loin devant les fréons (0,18 W/m2) et le protoxyde d'azote[59] (0,17 W/m2). Une molécule de méthane absorbe en moyenne 28 fois plus de rayonnement qu'une molécule de dioxyde de carbone sur une période de 100 ans, son potentiel de réchauffement global (PRG) est donc de 28 ; à échéance 20 ans, son PRG est même de 67.
Une étude publiée en décembre 2016 par plus de 80 scientifiques issus de laboratoires basés dans le monde entier[60], met en garde contre la sous-estimation usuelle de la contribution du méthane au réchauffement climatique : le méthane contribue pour 20 % au réchauffement en cours (contre 70 % pour le CO2), parce que, malgré sa concentration beaucoup plus faible, son potentiel de réchauffement global (PRG) est 28 fois plus élevé. Ceci implique que pour tenir l'objectif de rester sous la barre des 2 °C on ne peut se contenter de limiter les émissions de dioxyde de carbone, mais qu'il faut aussi réduire celles de méthane[61].
Méthane et ozone |
Le méthane interagit avec l'ozone, différemment dans les hautes et les basses couches de l'atmosphère.
Selon les modélisations tridimensionnelles disponibles en chimie de la troposphère, diminuer les émissions anthropiques de CH4 pourrait être « un puissant levier pour réduire à la fois le réchauffement climatique et la pollution de l'air par l'ozone de fond troposphérique »[62].
Variation historique (depuis l'Empire romain) |
Les émissions de méthane provenant des marais, des bovins, des feux de végétation ou des combustibles fossiles ont toutes une signature isotopique spécifique[63].
On sait aujourd’hui finement analyser le méthane piégé dans les glaces. Ces analyses ont récemment (2012) confirmé l'hypothèse posée il y a quelques années par le climatologue William Ruddiman, qui estimait que l'impact de l'humanité sur le climat date d'avant le récent « Anthropocène » et de bien avant la révolution industrielle.
Selon l'étude isotopique du méthane des glaces antarctiques parue dans la revue Nature en octobre 2012[64], les variations passées du taux de méthane et sa composition démontrent que des feux de végétation probablement anthropiques enrichissent depuis le XVIe siècle au moins le taux atmosphérique de méthane. L'analyse fine de deux carottes de glace du forage glaciaire NEEM1 (Groenland)[65] couvrant environ 2 000 ans a été faite avec une précision jamais atteinte en termes de dosage, analyse et résolution temporelle. Elle montre ou confirme qu'entre un siècle av. J.-C. et le XIXe siècle, le monde avait déjà connu trois périodes d'augmentation des taux de méthane (à l'échelle de quelques siècles) et une tendance longue à la décroissance de la signature isotopique 13C du méthane[64]. Selon ces données, les modèles d'équilibre isotopique de l'atmosphère[66] et les données paléoclimatiques de cette période (température, précipitations) ainsi qu'au vu des données de la démographie humaine, les feux de végétation liés à la déforestation, au chauffage, à la cuisson et la métallurgie avaient diminué au moment du déclin de l'Empire romain et de celui de la dynastie Han (Chine), pour réaugmenter durant les grandes déforestations et l'expansion médiévale[64]. L'homme semble être responsable de 20 à 30 % des émissions totales de méthane par les feux de végétation entre un siècle av. J.-C. et le XVIe siècle[64].
Variations récentes de teneur de l'air |
Le taux de méthane actuel dans l'atmosphère terrestre est d'environ 1 800 ppb, soit 0,00018 % ou 1,8 ppm. Il s'est maintenu[67],[68] entre 1780 et 1810 ppb de 2000 à 2010 avec une grande variation suivant la latitude[69]. Dans le passé, le taux de méthane dans l'atmosphère a varié souvent parallèlement à la température[réf. nécessaire]. Ce taux a augmenté d'environ 150 % depuis 1750 et atteint aujourd'hui un taux inégalé[70] dans l'histoire, principalement en raison des activités humaines. Une augmentation des teneurs a été constatée en 2008-2009[71]. Les modélisations informatiques de la cinétique du CH4 dans l'air ont permis de remonter à la source des émissions pour les vingt dernières années de mesures atmosphériques. Selon ces travaux, la réduction des émissions et/ou une utilisation plus efficace du gaz naturel dans l'hémisphère Nord (amélioration de l'étanchéité des tuyaux de gaz, récupération du grisou ou du gaz de décharge pour produire de l'électricité, etc.) ont permis une baisse des émissions dans les années 1990, mais une nette augmentation des émissions provenant de combustibles fossiles dans le nord de l'Asie a ensuite de nouveau été constatée (2006…). Le recul des zones humides, par drainage entre autres, et, dans une moindre mesure, les feux de brousse, expliquent aussi les variations mesurées du CH4 atmosphérique sur vingt ans[72].

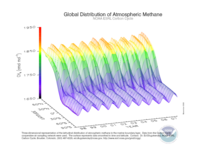
Augmentation du taux de méthane atmosphérique, en ppb.
 |
 |
|
Taux de méthane à la limite supérieure de la troposphère. |
Saisonnalité relevée par la NOAA. |
Le méthane serait responsable d'environ 20 % du réchauffement moyen enregistré depuis le début de la révolution industrielle.
On estime que sans sa présence, la température moyenne de surface de la Terre serait plus basse de 1,3 °C[réf. nécessaire]. Le calcul du PRG (pouvoir de réchauffement global) du méthane est périodiquement réévalué par le GIEC au vu des connaissances nouvelles.
Ce PRG tend à augmenter[73] (doublement du forçage radiatif additionnel qui lui est attribué entre 2007 et 2013, ce qui le rapproche du CO2 (il est passé de 0,48 à 0,97 W/m2 tous effets confondus et le PRG du CO2 est 1,68 W/m2), les scientifiques montrant qu'il contribue plus que ce que l'on pensait au réchauffement, avec une source nouvelle et en augmentation forte aux États-Unis qui sont les fuites de méthane des forages et installations de gaz de schiste ou gaz de couche ou encore les émissions du pergélisol[74], 22 janvier 2014 — d’après le dernier rapport du GIEC, paru en 2013, le PRG relatif du méthane est estimé à 28. Qu'est-ce que cela signifie exactement ?
L'augmentation régulière du méthane dans l'atmosphère pourrait aussi être en partie liée à une diminution de la teneur de l'atmosphère en radical hydroxyle (le destructeur naturel du méthane dans l'air)[75].
Origine des émissions |

Principales sources de méthane dans le monde (Global Methane Budget 2000-2012[76],[77])
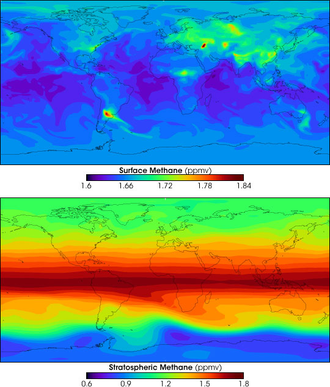
Analyse par satellite montrant les concentrations de méthane (parties par million en volume) en surface (en haut) et dans la stratosphère (en bas).
Globalement, les émissions de méthane vers l’atmosphère sont estimées à 500 Mt/an[réf. nécessaire], dont les trois quarts sont d’origine anthropique.
Les principales sources sont (ordre décroissant d'importance quantitative) estimée[réf. nécessaire] :
la fermentation anaérobie sous l'eau (32 % des émissions). Elles ont surtout lieu dans les zones humides (naturelles ou artificielles avec en particulier les rizières et les barrages hydroélectriques qui ont inondé des forêts ou accumulé une importante charge organique. Il peut aussi s'agir d'estuaires devenus dystrophes ou de n'importe quelle zone d'accumulation de pollution organique, décharge par exemple).
Les marais, les mangroves tropicales et les rizières sont sujets à l’action d'archées méthanogènes en milieu anaérobie.
La température agit sur les émissions, qui atteignent leur valeur maximale entre 37 °C et 48 °C, d’où une amplification des émissions en cas de réchauffement. En présence d'une quantité suffisante d'oxygène, l'activité des archées elles-mêmes contribue à échauffer le matériau, mais avec émission de CO2. L'analyse des gaz piégés il y a 10 000 ans dans les glaces polaires et l'étude du rapport isotopique carbone 13/carbone 12 du carbone de ces molécules de méthane (δ13CH4) ont montré un doublement des taux de CH4 lors de la dernière transition glaciaire-interglaciaire. Ce doublement est dû, à près de 50 %, aux régions marécageuses tropicales, renforcées par les émissions des tourbières boréales favorisées par la transition climatique[78] ;
les énergies fossiles (21 % des émissions). Le gaz naturel est composé à 90 % de méthane. Les fuites dans l'atmosphère lors de son extraction, de son transport, de son traitement et de sa distribution pourraient représenter jusqu'à 2 % de la production de gaz naturel, les 3/4 de ces fuites ayant lieu chez le client, après le compteur. Le graphe ci-contre montre l'importance des pertes lors de la production, notamment dans certains grands champs gaziers de mer Caspienne et de Sibérie.
De même, le gaz piégé dans les filons de charbon lors de sa formation (le grisou) est relâché lors de l’extraction du minerai. En 2018, les majors du pétrole, via l'OGCI (Oil and Gas Climate Initiative) notamment constitué de Total, Saudi Aramco, BP, récemment rejoints par les américains Chevron et ExxonMobil se sont pour la 1ère fois donné un objectifs (à horizon 2025) : « réduire d'un cinquième l'intensité méthane moyenne collective », soit passer de 0,32 % du méthane vendu perdu dans les fuites en 2017 à 0,25 % en 2015 (par rapport au volume total vendu), ce qui correspond - selon l'OGCI - à diminuer l'injection collective de méthane dans l'atmosphère de 350.000 t/an[79] ;
les ruminants. Dans les années 1990 on se rend compte que les élevages bovins contribuent significativement aux émissions mondiales de méthane[80] (environ 16 % vers 2010). En France, en 2008 l'élevage était la source (fumier d'étable compris) de 80 % du méthane émis (contre 69 % en 1990, avec un accroissement relatif de 4,6 % en 18 ans). L'élevage lui-même serait responsable de 92 % des émissions nationales de méthane (dont 70 % sont dus à la fermentation gastro-entérique (en) et 30 % aux émanations des lisiers).
Une seule vache peut émettre 100 à 500 litres de méthane par jour (5 % venant des flatulences et 95 % d'éructations liées à la rumination), mais la quantité de CH4 produite varie beaucoup selon l'alimentation de l'animal, avec par exemple une moyenne de 119 kg CH4/vache laitière (VL) et par an (variant de 63 à 102 kg) selon Dollé et al. (2006)[81], ou de 117,7 kg en moyenne (de 90 à 163 kg) selon Vermorel et al. (2008)[82], quand la production de lait passe de 3 500 à 11 000 kg/an[83]« les concentrés riches en amidon (orge, blé, maïs) ont un effet dépressif sur la méthanogénèse plus important que les concentrés riches en parois digestibles (pulpe de betterave). Martin et al. (2006) citent une étude qui montre que chez la vache laitière, le remplacement des pulpes de betteraves (70 % de la ration) par de l’orge a entraîné une diminution de 34 % des pertes d’énergie sous forme de méthane ». Des plantes plus riches en tanin (dont légumineuses telles que le sainfoin, le lotier et le sulla) diminuent la dégradation des protéines alimentaires mais aussi la méthanogenèse ruminale.
Les excréments (fumier d'étable) qui continuent leur décomposition avec une méthanisation plus ou moins anaérobie selon le contexte sont aussi source de méthane.
Parmi les solutions étudiées[84] : améliorer l'alimentation animale, éviter le stockage des déchets qui ne produisent du méthane qu'à l'abri de l'air, ou mieux récupérer ce méthane et le valoriser énergétiquement. Les féculents comme le soja augmentent la quantité de méthane émise par les bovins quand ils remplacent l'herbe dans l'alimentation industrielle. L’apport dans le rumen de bactéries acétogènes ou de capables d'oxyder le méthane), ou l'apport de lipides alimentaires riches en acides gras polyinsaturés dans la ration des ruminants est une piste prometteuse. Des essais menés sur vaches laitières au centre INRA de Clermont ont montré qu'un apport de 6 % de lipides issus de la graine de lin a diminué la production de méthane des animaux de 27 à 37 %[85]. Il existe aussi des archées méthanotrophes, mais leur rôle dans les écosystèmes est encore mal connu ; des chercheurs néo-zélandais ont réussi par des méthodes de sélection à réduire de 10 % les rots et les pets de moutons. Leurs travaux ont montré que ces rejets sont liés en partie à des traits héréditaires[86],[87].
les déchets humains (12 % des émissions). Les décharges fermentent et émettent de grandes quantités de méthane ; ce gaz pourrait être réutilisé comme source d’énergie[88] ;
la biomasse (10 % des émissions). Le méthane émis provient surtout de l'oxydation incomplète des végétaux, lors de certains processus de décomposition organique naturelle (comme les feuilles mortes des sous-bois accumulées sous l'eau, fermentation de vases riches en matière organique). Certaines espèces (Termites) peuvent produire des quantités significatives de méthane ;
les sédiments et les océans (4 % des émissions, mais qui pourrait fortement augmenter). Les hydrates contenant du méthane (clathrates) pourraient émettre du gaz en cas de perturbation de la température océanique et/ou du dégel de certains sols riches de la toundra sibérienne et canadienne, mais ces émissions sont limitées actuellement.
Toutefois, une augmentation de température entraine une augmentation de l'émission de CH4 par les clathrates. Cette source pourrait donc constituer une véritable bombe à retardement climatique en cas de réchauffement des fonds océaniques ;
les pergélisols : ils contiennent du méthane qu'ils libèrent en fondant quand le climat se réchauffe. Dans les années 2000, une étude internationale[89] (2003-2008) dans les eaux du plateau arctique de Sibérie orientale (plus de deux millions de kilomètres carrés) a montré que les pergélisols immergés perdent du méthane, plus et plus vite que prévu par les modèles : durant 5 ans, plus de 50 % des eaux de surface et plus de 80 % des eaux profondes étudiées présentaient un taux de méthane environ huit fois supérieur à la normale[90]. Le taux actuel moyen de CH4 en Arctique est d'environ 1,85 ppm, soit la plus élevée depuis 400 000 ans, alerte Natalia Chakhova[90]. Ce taux est encore plus élevé au-dessus du plateau arctique de Sibérie orientale et N. Chakhova parle de signes d'instabilité dans le permafrost immergé : « S'il continue à se déstabiliser, les émissions de méthane […] seront beaucoup plus importantes »[90].
Les variations futures de ces émissions sont incertaines, mais on prévoit une augmentation des sources fossiles, marines et agricoles, des déchets, du fait de la démographie mondiale, de l’industrialisation de certains pays et de la demande croissante en énergie, ainsi que du réchauffement climatique. Mais selon certaines sources[réf. nécessaire] en contradiction avec ces « prévisions » la concentration du méthane n'augmente plus.
Puits de méthane |
Ils sont encore mal cernés, mais la contribution du méthane à certains réseaux trophiques, et certains mécanismes de dégradation du méthane dans l'eau ou l'air pourraient avoir été sous-estimée.
On sait aujourd’hui que :
- les différents mécanismes d’élimination du méthane atmosphérique retirent environ 515 Mt/an ;
- le principal puits à CH4 est le radical hydroxyle OH• contenu dans l’atmosphère, qui contribue à 90 % de la disparition de CH4. Le radical OH•, agent oxydant des principaux polluants de l’atmosphère (CH4, CO, NOx, composés organiques), provient de la dissociation photochimique de O3 et de H2O. La teneur en radical hydroxyle est donc influencée par la concentration atmosphérique en CH4 mais aussi par celle de ses produits, dont CO. De même, divers mécanismes affectent la teneur en OH• :
- l’augmentation de concentration urbaine en NOx engendre plus de formation d’O3 et donc plus de dissociation en OH•,
- la chute de la concentration d’O3 stratosphérique induit plus de rayonnement UV atteignant la troposphère et donc plus de dissociation d’O3 troposphérique,
- l’augmentation de la vapeur d’eau résultant de l’augmentation de la température moyenne produit plus de nuages bloquant les flux de protons, effet réduisant la formation d’OH•, et plus de vapeur d’eau, réactif de formation d’OH•.
On a constaté que depuis 1750, le niveau d’OH• a diminué d’environ 20 % du fait de l’augmentation en CO et CH4, et est aujourd’hui stable. D’ici 2050, ce niveau devrait encore diminuer de 25 %, ce qui aura un impact important sur les teneurs en éléments traces gazeux. Les 10 % restants sont dus à l’oxydation du méthane en terrain sec par des archées méthanotrophes qui l’utilisent comme source de carbone, ainsi que par son transfert vers la stratosphère ;
- dans le sol, dans certaines nappes, dans les sédiments marins ou dans les zones humides vivent des archées qui consomment du méthane. Elles sont localement à l'origine d'un réseau trophique (pélagique) et d'un « puits biologique » de méthane importants, en mer mais aussi dans certains lacs, notamment en hiver où ces archées deviennent une source alimentaire plus importante pour le zooplancton, ce qui a été démontré par des analyses isotopiques[91], par exemple en alimentant certaines larves de chironomes (phénomène observé à la suite de la découverte inattendue de larves de chironomidae dont l'organismes était anormalement appauvri en 13C (toujours dans des lacs eutrophes et pauvres en oxygène)[92] ;
- le méthane est souvent associé à des HAP toxiques. Certaines des archées méthanotrophes sont mobiles et on a montré qu'elles pouvaient améliorer le transport des HAP dans le sous-sol. Cette qualité peut être utilisée pour épurer une nappe polluée par les HAP[93], mais peut aussi expliquer la pollution de nappes ou certaines distribution ou dispersion de HAP[94].
L'évolution de la concentration de l'air en méthane semble marquer le pas[95] (2007) ; cela pourrait s'expliquer par une destruction accélérée de molécules d'ozone O3, catalysée par des radicaux NO• en plus grande quantité[96],[97].
Réduire les émissions de méthane |
Il existe des moyens de diminuer les émissions de méthane pour diminuer son action sur l'effet de serre :
- capter le méthane, ou biogaz, émis au niveau des décharges d'ordures ou stations d'épuration et le brûler (la combustion forme du CO2 qui a un effet de serre moins important), ou le purifier par distillation puis l'injecter dans le réseau de distribution du gaz naturel[98], ce qui permettrait de remplacer en partie le gaz importé au lieu de brûler en torchère le gaz de décharge comme c'est souvent le cas actuellement.
- capter et utiliser le méthane, ou biogaz, produit au niveau des systèmes de stockage des effluents d'élevages ; récupérer le méthane émis lors de l'exploitation minière et après celle-ci.
- modifier l'alimentation des bovins pour réduire la production de méthane lors de la digestion : les chercheurs de l'Inra Clermont-Ferrand ont montré qu'en remplaçant une partie de leur alimentation par des lipides issus de la graine de lin, voire de colza, les bovins émettraient jusqu'à 40 % de méthane en moins ; 650 éleveurs de l'association Bleu Blanc Cœur se sont ainsi lancés dans cette démarche, et le projet européen Eco-méthane associe huit pays ; les producteurs suisses devraient s'engager massivement dans la démarche dès 2017 ; planter 250 000 hectares de lin, contre 50 000 aujourd'hui, suffirait pour l'élevage français. L'industrie étudie aussi des additifs alimentaires de synthèse agissant sur la flore microbienne des animaux[98].
- développer une riziculture moins productrice de méthane, diminuer les taux de fertilisants, lutter contre la turbidité des eaux et la production de sédiments méthanogènes, et donc en amont contre l'érosion, la régression et dégradation des sols. Des études menées en Asie ont montré que le simple fait de drainer les rizières deux fois par an permettrait de réduire leurs émissions de 80 %[98].
- au niveau personnel :
- réduire sa consommation de viande (en particulier bovine).
- réduire sa consommation de riz (voir le lien entre riziculture et l'effet de serre).
composter ses déchets en veillant à ce que le compost soit suffisamment aéré et drainé.
Vers une synthèse photocatalytique du méthane ? |
Des chercheurs du Laboratoire d’Électrochimie Moléculaire de l'Université Paris Diderot ont montré que la conversion photochimique de CO2 en méthane à température ambiante et par un catalyseur sélectif, abondant, non-polluant, non-toxique et peu coûteux[Lequel ?], associé à la lumière solaire était possible, ce qui ouvre de nouvelles perspectives qui, à long terme, peuvent espérer aboutir à des applications industrielles[99].
Elle pourrait alors - en principe - réduire les effets de la consommation de combustibles fossiles et aider à diminuer les émissions de CO2[100],[101], ou justifier que l’on continue à brûler des combustibles fossiles.
Jusqu’ici les principales voies explorées pour l’élimination physicochimique du CO2 industriel étaient principalement électrochimiques. Pour être « soutenables », elles nécessitent une production renouvelable et propre d’électricité[102] mais des approches photochimiques activées par la lumière du soleil sont également envisageables[103],[104]. Parmi les photocatalyseurs et les électrocatalyseurs moléculaires inventoriés, seuls quelques-uns semblent à la fois stables et sélectifs pour la réduction du CO2 ; Mais la plupart de ces catalyseurs produisent surtout du CO (toxique) ou de l’acide formique (HCOOH)[99]. Les catalyseurs pouvant dans certaines conditions générer avec un rendement faible à modéré des hydrocarbures semblent encore plus rares[105],[106],[107],[108],[109],[110],[111],[112].
Un complexe électrocatalytique moléculaire s’était déjà montré comme le plus efficace et le plus sélectif pour convertir le CO2 en CO ; il s’agit de la tétraphénylporphyrine de fer fonctionnalisée par des groupes triméthylammonium[113],[114],[115]. On a montré en 2017 que sous irradiation ultraviolette il peut aussi catalyser la réduction de CO2 en méthane à température et pression ambiantes.
Utilisé dans une solution d'acétonitrile contenant un photosensibilisateur et un donneur d'électrons sacrificiel, ce catalyseur fonctionne avec régularité durant quelques jours, en produisant principalement du CO (par photoréduction du CO2) mais Heng Rao et ses collègues ont constaté qu’une exposition du CO2 à ce produit conduite en deux stades permet d'abord de réduire le CO2 en CO puis de synthétiser du méthane (avec une sélectivité atteignant jusqu'à 82 % et un « rendement quantique » (efficacité légère) de 0,18 %).
On est encore très loin d’un prototype industriel, mais les auteurs estiment que cette expérience pourrait être un prélude à d’autres découvertes de catalyseurs moléculaires qui rendraient possible une production lente mais douce d'un combustible gazeux à partir de CO2 et des UV de la lumière solaire[99].
Biosynthèse du méthane |
Du méthane pur est produit par quelques espèces microbiennes dites « méthanogènes ». Cette biosynthèse intéresse la recherche (biomimétique) éventuellement), dans le domaine des énergies renouvelables notamment.
La biogenèse du méthane est permise par la méthyl-coenzyme M réductase, une enzyme qui est aussi responsable de l'utilisation du méthane comme source d'énergie (par oxydation anaérobie)[116].
Cette enzyme utilise un facteur auxiliaire appelé « coenzyme F430 », un tétrapyrrole modifié contenant du nickel qui favorise la catalyse à travers un intermédiaire méthyle radical/Ni(II)-thiolate intermédiaire. On ignore encore comment la coenzyme F430 est synthétisée (à partir d'une composé commun, le uroporphyrinogène III), mais on sait que la voie de synthèse implique une chélation, une amidation, une réduction d'anneau macrocyclique, une lactamisation et la formation d'anneau carbocyclique[116].
Les protéines catalysant la biosynthèse de la coenzyme F430 (à partir de sirohydrochlorine, appelée CfbA-CfbE) ont été récemment identifiées, ce qui ouvre la porte au développement de systèmes recombinants basés sur ces groupes métalloprothétiques[116]. Cette meilleure compréhension de la biosynthèse d'un coenzyme de la production de méthane par les microbes complète les voies biosynthétiques connues pour une famille des composés importants incluant la chlorophylle, l'hème et la vitamine B12[117],[116].
Méthane et biodiversité |
Le méthane est associé à des milieux anoxiques pauvres en espèce, mais on y trouve quelques espèces méthanotrophes et on a identifié en mer du Nord une espèce nouvelle de nématodes sans bouche ni intestin (Astomonema southwardorum (nl)), qui dominait la microfaune du sédiment d'une zone riche en méthane[118].
Notes et références |
Notes |
Le pouvoir calorifique à 25 °C vaut PCI = 890,8 × 103 J/mol et le volume molaire V = 22,4 × 10−3 m3/mol donc PCI/V = 39,77 × 106 J/m3. La masse molaire vaut M = 16,0425 × 10−3 kg/mol donc PCI/M = 55,53 × 106 J/kg.
1 kWh = 3,6 × 106 J.
Références |
METHANE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
Entrée de « Methane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 mai 2009 (JavaScript nécessaire)
« METHANE », sur Hazardous Substances Data Bank (en)
(en) James E. Mark, Physical Properties of Polymer Handbook, Springer, 2007, 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294
(en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
(en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Pressures. Part I. Aliphatic Hydrocarbons », Journal of Physical and Chemical Reference Data, vol. 35, no 4, 18 septembre 2006, p. 1461 (DOI 10.1063/1.2201061)
(en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 32, no 4, 4 août 2003, p. 1411 (DOI 10.1063/1.1556431)
(en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, 1er juillet 2010, 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40
(en) Irvin Glassman et Richard A. Yetter, Combustion, Elsevier, 2008, 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6
(en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., 1996(ISBN 0-88415-857-8, 978-0-88415-858-5 et 978-0-88415-859-2)
(en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, 18 juin 2002, 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
Magalie Roy-Auberger, Pierre Marion, Nicolas Boudet, Gazéification du charbon, éd. Techniques de l'Ingénieur, référence J5200, 10 décembre 2009, p. 4
(en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, 17 juin 2008, 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205
« méthane » sur ESIS, consulté le 15 février 2009
Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
« Méthane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
(en) United Nations Environment Programme (UNEP) GRID-Arendal – 2003, Climate Change 2001: Working Group I: The Scientific Basis. 4.2 Trace Gases: Current Observations, Trends, and Budgets – 4.2.1 Non-CO2 Kyoto Gases – 4.2.1.1 Methane (CH4).
« Montée en flèche des concentrations de gaz à effet de serre: nouveau record> », sur OMM, 30 octobre 2017(consulté le 15 novembre 2017).
(en) J.T. Kiehl et Kevin E. Trenberth, « Earth’s Annual Global Mean Energy Budget », Bull. Am. Meteorol. Soc., vol. 78, no 2, février 1997, p. 197-208 (DOI 10.1175/2008BAMS2634.1, lire en ligne)
« Le méthane - D’où vient-il et quel est son impact sur le climat ? », Rapport voté le 9 janvier 2013, vol. Rapport de l'Académie des technologies, 9 janvier 2013, Chapitres 1 et 6 p. 11-24 et 107-120, 170 (lire en ligne)
Biographie | http://www.cartage.org.lb/en/themes/biographies/MainBiographies/V/Volta/1.html
Alessandro Volta, Lettere del Signor Don Alessandro Volta… Sull' Aria Inflammabile Nativa delle Paludi (Milan, éd. Guiseppe Marelli, 1777).
« Methane », BookRags (consulté le 26 janvier 2012)
Söhngen N.L (1910), Sur le rôle du methane dans la vie organique, Recueil des Travaux Chimiques des Pays-Bas et de la Belgique, 29(7), 238-274.
Biogaz issus de déchets alimentaires pour cogénération / CHP
Roger P.A, Le Mer J & Joulian C (1999) L'émission et la consommation de méthane par les sols : mécanismes, bilan, contrôle. Comptes Rendus de l'Académie d'Agriculture, 85(6), 193-210|résumé.
(en) F. Suarez, J. Furne, J. Springfield et M Levitt, « Insights into human colonic physiology obtained from the study of flatus composition », Am. J. Physiol., vol. 272 (5 Pt 1), 1997, G1028–33.
Laurent Sacco, « Des suintements de méthane préoccupants dans le Pacifique », sur Futura-Sciences, 16 décembre 2014(consulté le 22 janvier 2015),(en) Susan L. Hautala et al., « Dissociation of Cascadia margin gas hydrates in response to contemporary ocean warming », sur Wiley-On line library, 5 décembre 2014(consulté le 3 octobre 2016)
Présentation du programme MARMESONET par IFREMER
Documentaire français de Pascal Cuissot, Luc Riolon et Rachel Seddoh, Arte, 5 décembre 2014
INERIS, Rapport d'étude : L'élaboration des plans de prévention des risques miniers, Guide méthodologique, volet technique relatif à l'évaluation de l'aléa. Les risques de mouvements de terrain, d'inondations et d'émissions de gaz de mine, Rapport DRS 06 51198/R01, 4 mai 2006, p. 81/140, chap. Transport de gaz sous forme dissoute dans l'eau.
Jorge A. Ramirez, Andy J. Baird, Tom J. Coulthard and J. Michael Waddington (2015), Ebullition of methane from peatlands: Does peat act as a signal shredder ?, Geophysical Research Letters, 42, 9, (3371-3379).
Xi Chen, Karina V. R. Schäfer and Lee Slater (2017), Methane emission through ebullition from an estuarine mudflat: 2. Field observations and modeling of occurrence probability, Water Resources Research, 53, 8, (6439-6453)
Zhaosheng Fan, Anthony David McGuire, Merritt R. Turetsky, Jennifer W. Harden, James Michael Waddington and Evan S. Kane (2012), The response of soil organic carbon of a rich fen peatland in interior Alaska to projected climate change, Global Change Biology, 19, 2, (604-620).
Jorge A. Ramirez, Andy J. Baird, Tom J. Coulthard and J. Michael Waddington (2015), Testing a simple model of gas bubble dynamics in porous media, Water Resources Research, 51, 2, (1036-1049).
Jorge A. Ramirez, Andy J. Baird and Tom J. Coulthard (2016), The effect of pore structure on ebullition from peat, Journal of Geophysical Research: Biogeosciences, 121, 6, (1646-1656).
Jorge A. Ramirez, Andy J. Baird and Tom J. Coulthard (2017), The effect of sampling effort on estimates of methane ebullition from peat, Water Resources Research, 53, 5, (4158-4168).
Nguyen Thanh Duc, Samuel Silverstein, Lars Lundmark, Henrik Reyier, Patrick Crill & David Bastviken, Automated Flux Chamber for Investigating Gas Flux at Water–Air Interfaces, Environmental Science & Technology, 10.1021/es303848x, 47, 2, (968-975), (2012).
Genevieve L. Noyce, Ruth K. Varner, Jill L. Bubier and Steve Frolking, Effect of Carex rostrata on seasonal and interannual variability in peatland methane emissions, Journal of Geophysical Research: Biogeosciences, 119, 1, (24-34), (2014).
Sparkle L. Malone, Gregory Starr, Christina L. Staudhammer and Michael G. Ryan (2013), Effects of simulated drought on the carbon balance of Everglades short‐hydroperiod marsh, Global Change Biology, 19, 8, (2511-2523).
Température d'auto-inflammation du méthane dans l'air.
(en) NASA Explores the Red Planet, 15 janvier 2009, Martian Methane Reveals the Red Planet is not a Dead Planet.
(en) Michael J. Mumma, Geronimo L. Villanueva, Robert E. Novak, Tilak Hewagama, Boncho P. Bonev, Michael A. DiSanti, Avi M. Mandell et Michael D. Smith, « Strong Release of Methane on Mars in Northern Summer 2003 », Science, vol. 323, no 5917, 20 février 2009, p. 1041-1045 (DOI 10.1126/science.1165243, lire en ligne [PDF])
(en) Franck Lefèvre et François Forget, « Observed variations of methane on Mars unexplained by known atmospheric chemistry and physics », Nature, vol. 40, 6 août 2009, p. 720-723 (DOI 10.1038/nature08228, résumé)
(en) NASA Explores the Red Planet, 15 janvier 2009, Mars Methane Press Conference - Media Page.
(en) Todd M. Hoefen, Roger N. Clark, Joshua L. Bandfield, Michael D. Smith, John C. Pearl et Philip R. Christensen, « Discovery of Olivine in the Nili Fossae Region of Mars », Science, vol. 203, no 5645, 24 octobre 2003, p. 627-630 (DOI 10.1126/science.1089647, résumé)
(en) NASA Mars Reconnaissance Orbiter, 18 décembre 2008, Mineral Spectra from Nili Fossae, révélant la présence d'argiles riches en fer et en magnésium, d'olivine et de carbonate de magnésium
(en) 40th Lunar and Planetary Science Conference – 2009, B.L. Ehlmann, J.F. Mustard et S.L. Murchie, Detection of serpentine on Mars by MRO-CRISM and possible relationship with olivine and magnesium carbonate in Nili Fossae.
(en) ESA News – 20 septembre 2004 Water and methane maps overlap on Mars: a new clue?
Hand E (2018) On Mars, atmospheric methane—a sign of life on Earth—changes mysteriously with the seasons, Science News, 03 Janvier
Brève d’Actualité Pour la science, no 405, juillet 2011, p. 7
Brève avec Interview d'Edith Labelle, de l'Institut de technologie des procédés chimiques et de l'environnement du CNRC par nrc-cnrc. 2010-05-19, consulté 2010/07/14
Communiqué sur le site de veille technologique de l'ADIT
(de) Communiqué sur le site de l'entreprise Fraunhofer
(en) Specht et al., Storing bioenergy and renewable electricity in the natural gas grid, p. 70.
(en) GIEC, « 5eme rapport du GIEC » [PDF], sur ipcc.ch, 2013(consulté le 17 novembre 2015), p. 714
GIEC, « Changements climatiques 2013, Les éléments scientifiques, Résumé à l’intention des décideurs » [PDF], sur ipcc.ch, 2013(consulté le 17 novembre 2015), p. 12
Benjamin Dessus et Bernard Laponche, « Forçage radiatif et PRG du méthane dans le rapport AR5 du GIEC » [PDF], sur global-chance.org, 7 mai 2014(consulté le 17 novembre 2015)
dont, en France, le CEA, le CNRS et l'université de Versailles Saint-Quentin-en-Yvelines (UVSQ).
A.F., « Les émissions de méthane, un danger pour le climat », Les Échos.fr, 13 décembre 2016(lire en ligne)
Fiore, A.M., D.J. Jacob, B.D. Field, D.G. Streets, S.D. Fernandes et C. Jang (2002), Linking ozone pollution and climate change: The case for controlling methane, Geophys. Res. Lett., 29(19), 1919, DOI:10.1029/2002GL015601 (Résumé)
Université Grenoble-Alpes, Recherche, Du méthane émis par les activités humaines depuis l'Empire romain, 4 octobre 2012
(en) C.J. Sapart, G. Monteil, M. Prokopiou, R.S.W. Van de Wal, J.O. Kaplan, P. Sperlich, K.M. Krumhardt, C. Van der Veen, S. Houweling, M.C. Krol, T. Blunier, T. Sowers, P. Martinerie, E. Witrant, D. Dahl-Jensen et T. Röckmann, « Natural and anthropogenic variations in methane sources during the past two millennia », Nature, vol. 490, 4 octobre 2012(DOI 10.1038/nature11461)
Présentation officielle du forage glaciaire NEEM, Groenland (2 537 mètres de forage atteints en juillet 2010)
LGGE-GIPSA-lab, Grenoble-INP modèle numérique LGGE-GIPSA
Concentration du méthane mesurée à Mauna Loa (Hawaï)
Site du CSIRO (graphique montrant une stabilisation du CH4 atmosphérique (à l'époque non expliquée) de 2000 à 2003
Évolution du taux de méthane atmosphérique
http://www.ipcc.ch/pdf/assessment-report/ar4/wg1/ar4-wg1-spm-fr.pdf
Bulletin ADIT pour l'Australie numéro 61 (2009 01 15) - Ambassade de France en Australie / ADIT, reprenant une information du CSIRO
Explaining the methane mystery, communiqué du CSIRO, 2006, 06/188.
Carbone 4 (2014) Le PRG du méthane s’enflamme : la contribution à l’effet de serre du CH4 se fait de plus en plus sentir…, 2014-01-22
(2013) Des résultats inquiétants sur le méthane, dans le dernier rapport du GIEC, 2013-11-07
Paul Voosen(2016) Why is atmospheric methane surging? (Hint: It's not fracking), Science, 21 décembre 2016.
M. Saunois et al., (-2016), The Global Methane Budget 2000-2012 (http://www.earth-syst-sci-data.net/8/697/2016/), Earth System Science Data, DOI:10.5194/essd-8-697-2016
M. Saunois, R.B. Jackson, P. Bousquet, B. Poulter et J.G. Canadell, The growing role of methane in anthropogenic climate change, 2016, Environmental Research Letters, vol. 11, 120207, DOI:10.1088/1748-9326/11/12/120207.
Nature, avril 2008
AFP (2018) Les majors du pétrole s'engagent à réduire leurs émissions de méthane , 24 sept. 2018
Sauvant, D. (1992), La production de méthane dans la biosphère : le rôle des animaux d’élevage, Le Courrier de l’Environnement, 18, 65-70.
Dollé J.B., Robin P., (2006) : Émissions de gaz à effet de serre en bâtiment d’élevage bovin. In Four rages 186, p. 205
Vermorel M., Jouany J.P., Eugène M., Sauvant D., Noblet J., Dourmad J.Y. (2008), Évaluation quantitative des émissions de méthane entérique par les animaux d'élevage en 2007 en France, INRA Production Animale 21, p. 403-418
CIVAM de Bretagne (2010), Synthèse bibliographique 2010 – Plan d’action Agriculture Durable des CIVAM de Bretagne [PDF], 6 p.
Martin C., Morgavi D., Doreau M., Jouany J.P., (2006) Comment réduire la production de méthane chez les ruminants ? In Fourrages 187, p. 283-300
Journal of Animal Science, 2007
« En Nouvelle-Zélande, on élève des moutons qui pètent et rotent moins », sur huffingtonpost
(en) « New Zealand scientists are breeding sheep to fart and burp less », sur abc.net.au
AFP. Des bus roulent déjà à Stockholm, et en essai à Oslo et Lille.
Étude dirigée par Natalia Chakhova et Igor Semiletov, Université de l'Alaska de Fairbanks
TF1, rubrique Science/Environnement, mars 2010 (consulté le 29 avril 2010).
Bastviken, D., Ejlertsson, J., Sundh, I. et Tranvik, L. (2003), Methane as a source of carbon and energy for lake pelagic food webs, Ecology, 84(4), 969-981 (résumé).
Roger I. Jones, Clare E. Carter, Andrew Kelly, Susan Ward, David J. Kelly, Jonathan Grey (2008), Widespread contribution of methane-cycle bacteria to the diets of lake profundal chironomid larvae, Ecology, vol. 89, no 3, mars 2008, p. 857-864, DOI:https://dx.doi.org/10.1890/06-2010.1 (résumé)
Jenkins, Michael B. ; Lion, Leonard W., Mobile bacteria and transport of polynuclear aromatic hydrocarbons in porous media, Applied and Environmental Microbiology, octobre 1993, 59 (10):3306-3313 (ISSN 0099-2240) (résumé et lien)
Jenkins MB, Chen JH, Kadner DJ, Lion LW., Methanotrophic Bacteria and Facilitated Transport of Pollutants in Aquifer Material, Applied and Environmental Microbiology, octobre 1994, 60(10)3491-3498
Évolution de la concentration de méthane dans l'atmosphère
Réactivité du méthane et de l'ozone en haute atmosphère
Inversion des sources et puits de gaz dans l'atmospgère
Frank Niedercorn, « Des pistes contre les émissions de méthane », Les Échos.fr, 17 janvier 2017(lire en ligne)
Heng Rao, Luciana C. Schmidt, Julien Bonin et Marc Robert, « Visible-light-driven methane formation from CO2 with a molecular iron catalyst », Nature, vol. 548, 2017, p. 74–77 (DOI 10.1038/nature23016, résumé)
Jhong, H.-R. M., Ma, S. & Kenis, P. J. A. (2013), Electrochemical conversion of CO2 to useful chemicals: current status, remaining challenges, and future opportunities ; Curr. Opin. Chem. Eng. 2, 191–199
Aresta, M., Dibenedetto, A. & Angelini, A. (2014) Catalysis for the valorization of exhaust carbon: from CO2 to chemicals, materials, and fuels. Technological use of CO2. Chem. Rev. 114, 1709–1742
Parajuli, R. et al. (2015), Integration of anodic and cathodic catalysts of Earth-abundant materials for efficient, scalable CO2 reduction. Top. Catal. 58, 57–66
Sahara, G. & Ishitani, O. (2015) Efficient photocatalysts for CO2 reduction. Inorg. Chem. 54, 5096–5104
Takeda, H., Cometto, C., Ishitani, O. & Robert, M. (2017), Electrons, photons, protons and Earth-abundant metal complexes for molecular catalysis of CO2 reduction. ACS Catal. 7, 70–88
Shen, J. et al. (2015) Electrocatalytic reduction of carbon dioxide to carbon monoxide and methane at an immobilized cobalt protoporphyrin. Nat. Commun. 6, 8177
Weng, Z. et al. (2016), Electrochemical CO2 reduction to hydrocarbons on a heterogeneous molecular Cu catalyst in aqueous solution. J. Am. Chem. Soc. 138, 8076–8079
Manthiram, K., Beberwyck, B. J. & Alivisatos, A. P. Enhanced electrochemical methanation of carbon dioxide with a dispersible nanoscale copper catalyst. J. Am. Chem. Soc. 136, 13319–13325 (2014)
Wu, T. et al. (2014), A carbon-based photocatalyst efficiently converts CO2 to CH4 and C2H2 under visible light. Green Chem. 16, 2142–2146
AlOtaibi, B., Fan, S., Wang, D., Ye, J. & Mi, Z. (2015), Wafer-level artificial photosynthesis for CO2 reduction into CH4 and CO using GaN nanowires. ACS Catal. 5, 5342–5348
Liu, X., Inagaki, S. & Gong, J. (2016), Heterogeneous molecular systems for photocatalytic CO2 reduction with water oxidation. Angew. Chem. Int. Ed. 55, 14924–14950
Wang, Y. et al. (2016), Facile one-step synthesis of hybrid graphitic carbon nitride and carbon composites as high-performance catalysts for CO2 photocatalytic conversion. ACS Appl. Mater. Interf. 8, 17212–17219
Zhu, S. et al. (2016) Photocatalytic reduction of CO2 with H2O to CH4 over ultrathin SnNb2O6 2D nanosheets under visible light irradiation. Green Chem. 18, 1355–1363
Azcarate, I., Costentin, C., Robert, M. & Savéant, J.-M. (2016), A study of through-space charge interaction substituent effects in molecular catalysis leading to the design of the most efficient catalyst of CO2-to-CO electrochemical conversion. J. Am. Chem. Soc. 138, 16639–16644
Bonin, J., Maurin, A. & Robert, M. Molecular catalysis of the electrochemical and photochemical reduction of CO2 with Fe and Co metal based complexes. Recent advances. Coord. Chem. Rev. 334, 184–198 (2017)
Costentin, C., Robert, M., Savéant, J.-M. & Tatin, A. (2015), Efficient and selective molecular catalyst for the CO2-to-CO electrochemical conversion in water. Proc. Natl Acad. Sci. USA 112, 6882–6886
Simon J. Moore, Sven T. Sowa, Christopher Schuchardt, Evelyne Deery, Andrew D. Lawrence et al. (2017), Elucidation of the biosynthesis of the methane catalyst coenzyme F430, Nature, mis en ligne le 22 février 2017, DOI:10.1038/nature21427 (résumé)
Tadhg P. Begley (2017), Biochemistry: Origin of a key player in methane biosynthesis ; mis en ligne le 22 février 2017 ; DOI:10.1038/nature21507, Nature ; (résumé)
Austen, M.C., Warwick, R.M. et Ryan, K.P. (1993), Astomonema southwardorum sp. nov., a gutless nematode dominant in a methane seep area in the North Sea, Journal of the Marine Biological Association of the United Kingdom, 73(03), 627-634.
Voir aussi |
Bibliographie |
- [Organisation météorologique mondiale] (2013), Nouveaux records pour les concentrations de gaz à effet de serre dans l’atmosphère – La teneur de l’atmosphère en gaz à effet de serre a atteint un niveau inégalé en 2012, poursuivant et accélérant une progression qui alimente le changement climatique et façonnera l’avenir de notre planète pendant des milliers d’années, communiqué publié à Genève, 6 novembre 2013.
- Benjamin Dessus, Effet de serre : on oublie le méthane, in Alternative Économique, 2010/4, no 290, 128 p.
Articles connexes |
- Reformage du méthane
- Gaz à effet de serre
- Changement climatique
- Pyrolyse
- Gazogène
- Environnement
- Hydrate de méthane
- Méthanisation
Métabolisme méthanogène (espèce produisant du méthane)
Méthanotrophes (espèces consommant du méthane pour s'en nourrir)
- Portail de l’énergie
- Portail de la chimie
6OIGJ wbARrZWrC i2 n47G8lCiCSfJIDIYWFcH71M9sY






