Bicarbonate de sodium

Multi tool use
| Bicarbonate de sodium | ||
 | ||
 | ||
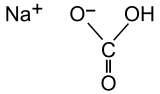
| Structure et poudre de bicarbonate de sodium | ||
| Identification | ||
|---|---|---|
Nom UICPA |
hydrogénocarbonate de sodium |
|
Synonymes |
bicarbonate de soude, carbonate acide de sodium (ancienne appellation en pharmacie). |
|
No CAS |
||
| NoECHA |
100.005.122 | |
No EC |
205-633-8 |
|
Code ATC |
B05 B05 « QG04BQ01 » |
|
No E |
E500(ii) |
|
SMILES |
C(O)(=O)[O-].[Na+] , |
|
InChI |
InChI : InChI=1/CH2O3.Na/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 |
|
| Apparence |
solide blanc en prisme (pur), mais aussi en pratique de formes variables[1] |
|
| Propriétés chimiques | ||
Formule brute |
CHNaO3NaHCO3 |
|
Masse molaire[2] |
84,0066 ± 0,0018 g/mol C 14,3 %, H 1,2 %, Na 27,37 %, O 57,14 %, 84,01 g/mol |
|
pKa |
pKa1=10,33, pKa2=6,33 (couples HCO3− / CO32− et CO2 dissous / HCO3−) |
|
| Propriétés physiques | ||
T° fusion |
270 °C (décomposition en NaOH par perte de CO2) mais bicarbonate avec traces d'acides se décompose lentement dès 50 °C en solide Na2CO3, gaz CO2 et vapeur d'eau[3] |
|
Solubilité |
87 g·l-1 (eau, 20 °C)[1] Insol. dans EtOH et alcool à 95%[3] |
|
Masse volumique |
2,20 g·cm-3 à (20 °C, 2,22 g·cm-3 selon fiche technique[4] |
|
| Thermochimie | ||
ΔfH0solide |
−947 kJ·mol-1(24,85 °C)[5] |
|
ΔfusH° |
136 J·mol-1·K-1(24,85 °C) |
|
Cp |
87,7 kJ·K-1·mol-1 (25 °C)[3] |
|
| Cristallographie | ||
Système cristallin |
monoclinique |
|
| Propriétés optiques | ||
Indice de réfraction |
1,500 |
|
| Précautions | ||
SIMDUT[6] | ||
Produit non contrôlé Ce produit n'est pas contrôlé selon les critères de classification du SIMDUT. |
||
| Considérations thérapeutiques | ||
| Classe thérapeutique |
Antiacide |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
modifier |
||
Le bicarbonate de sodium .mw-parser-output .prononciation>a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/8/8a/Loudspeaker.svg/11px-Loudspeaker.svg.png")center left no-repeat;padding-left:15px;font-size:smaller}Écouter, ou bicarbonate de soude (abus de langage) ou carbonate monosodique ou carbonate acide de sodium (employée dans la composition des pâtisseries industrielles) ou hydrogénocarbonate de sodium en nomenclature moderne, est un composé chimique inorganique décrit par la formule brute NaHCO3.
C'est un composé ionique blanc de l'anion hydrogénocarbonate et du cation sodium, qui se présente sous forme de poudres. La forme ultra pure, très rare, est constituée de cristaux prismatiques blancs.
Ce corps minéral anhydre, sous l'appellation minéralogique de nahcolite, apparaît néanmoins dans la nature sous la forme d'agrégats de cristaux prismatiques, le plus souvent en veines fibreuses ou en concrétions. Au laboratoire, l'hydrogénocarbonate de sodium apparaît sous la forme de fins cristaux blancs, solubles dans l'eau.
Sommaire
1 Historique
2 Production et synthèse
3 Propriétés physico-chimiques
4 Types de bicarbonate
5 Utilisations
5.1 Usage domestique
5.1.1 Pour l'hygiène et les soins du corps
5.1.2 Produit d'entretien à la maison
5.1.3 Au garage[13]
5.1.4 Au jardin
5.2 Usage alimentaire
5.3 Usage médical
5.4 Lutte contre les incendies
5.5 Autres utilisations
6 Notes et références
7 Voir aussi
7.1 Bibliographie
7.2 Articles connexes
7.3 Liens externes
Historique |
Les Égyptiens de l'Antiquité connaissaient déjà la poudre blanche que forme le bicarbonate de soude, sur les bords des eaux saumâtres de nombreux lacs africains, souvent à côté des efflorescences pures de natron, un minéral à base d'un sel décahydraté de carbonate de sodium, très recherché pour les rituels d'embaumement. Cette poudre de bicarbonate de sodium, plus ou moins pure, apparaissait lors de l'évaporation des lacs salés à eau bicarbonatée. Il est probable qu'ils l'employaient pour maints usages, comme se frotter les dents ou purifier leur logis, pour l'hygiène ritualisée de leur corps, mais aussi une grande part de nos usages actuels[7].
Le bicarbonate de soude, nom ancien par abus de langage et impropre[précision nécessaire] du NaHCO3, n'est pas considéré par les Anciens comme un alcali.

« Préparation du bicarbonate de soude avec l'acide carbonique qui se dégage des eaux de Vichy », Les merveilles de l'industrie, 1873.
On le trouve souvent dans les eaux de sources chaudes ou sources thermales antiques[8]. Il est parfois dénommé sel Vichy exclusivement sous forme d'un monohydrate[9]. Lorsque les eaux chaudes des sources bicarbonatées se refroidissent, le bicarbonate de sodium se dépose facilement, sa solubilité à 20 °C et à pression ambiante n'est que 9,61 g/100 g d'eau.
Il est étonnant de lire, dans le journal de voyage de Michel de Montaigne, la description d'eaux à écume blanche qui se fixe, produit une croûte dure sur l'eau, s'incruste et reste aussi ferme que la glace[10]. Un ramassage à l'aide de toiles permet de recueillir le produit naturel, pilé en poudre mise en flacon et exportée au loin, en particulier pour nettoyer les dents. D'après cette description naturaliste, elle apparaît principalement à base de bicarbonate de sodium ou de sel Vichy.
En 1791, le chimiste français Nicolas Leblanc élabore par un procédé artificiel le carbonate de sodium, tel que nous le connaissons aujourd'hui. Mais le raffinage industriel du carbonate de sodium pour donner du bicarbonate de sodium n'a été mis au point qu'en 1846 par deux boulangers new-yorkais : John Dwight et Austin Church.
Production et synthèse |
Le bicarbonate de sodium peut être obtenu à partir de gisements naturels de natron ou de trona, donc en partant de carbonate de sodium hydraté, mais il est plus souvent recueilli à moindre frais en traitant les eaux saumâtres, par exemple celles des zones productrices de ces précédents minerais.
Le procédé Solvay, mis en œuvre à échelle industrielle par le chimiste belge Ernest Solvay, produit du carbonate de sodium Na2CO3 à partir de sel et de craie, mais en passant par le bicarbonate de sodium en voie humide, qui précipite. Mais, pour des raisons techniques ou de pureté, ce carbonate de sodium ou soude Solvay redonne du bicarbonate de sodium selon la réaction suivante (1) :
- Na2CO3 + H2O + CO2 → 2 NaHCO3.
Propriétés physico-chimiques |
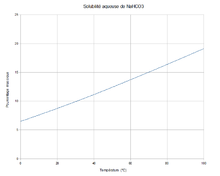
Solubilité de NaHCO3 dans l'eau.
L'hydrogénocarbonate de sodium montre une faible solubilité dans l'eau. C'est sa facile précipitation à froid qui est utilisée pendant la seconde étape du procédé Solvay, promouvant la voie humide par les saumures.
Dans 100 g d'eau on peut en principe dissoudre 6,9 g à 0 °C (eau froide), 8,15 g à 10 °C, 9,6 g à 20 °C, 11,1 g à 30 °C, 12,7 g à 40 °C, 14,45 g à 50 °C et 16,4 à 60 °C (eau chaude)[11]. En pratique, on n'arrive à en dissoudre que 9,57 g à 20 °C et 19,7 g à 80 °C.
L'ion hydrogénocarbonate est amphotère, il participe à deux couples acido-basiques : HCO3− / CO32− de pKa 10,3 et CO2 dissous / HCO3− de pKa 6,33. En abaissant le pH (potentiel d'hydrogène), on obtient donc un dégagement d'acide carbonique dissous, voire une effervescence rapide caractéristique des anions carbonates ou des roches carbonatées en réaction à l'acide fort. Par augmentation du pH, c'est-à-dire en alcalinisant le milieu, on obtient de la soude ou carbonate de sodium en milieu aqueux.
Dissous dans l'eau, il évite la précipitation, d'ordinaire si facile, des ions Ca2+ en carbonate de calcium ou calcaire. Voilà l'origine de ses propriétés adoucissantes.
Le bicarbonate de sodium, solide et impur, perd du dioxyde de carbone, très faiblement à partir de 50 °C mais plus fortement à partir de 70 °C. Il s'agit de la réaction inverse de dégradation (1) de la soude Solvay :
- 2 NaHCO3 poudre chauffée → Na2CO3 solide + CO2 gaz + H2O gaz
Plus la température s'élève, plus un véritable dégazage de CO2 est constaté, notamment à 100 °C. Il est ainsi utilisé comme un agent chimique levant de pâtes farineuses et de divers gâteaux. La levure chimique comprend NaHCO3, mais aussi deux acides et un liant comme l'amidon. Le premier des deux acides est l'acide tartrique humide qui permet la naissance de cavité à faible température. Un second sel acide est nécessaire pour son action d'accroissement de la cavité à température plus élevée[12].
Piégé dans le réseau élastique du gluten, protéine du blé permettant d'obtenir par exemple une pâte à pain plastique et malaxable mécaniquement, ce gaz en expansion, émis par l'action différenciée des deux acides, augmente le volume de la pâte avant d'être évacué en fin de cuisson. Le gâteau révèle finalement une texture plus moelleuse.
Il est converti en carbonate de sodium à 100 °C[3].
- 2 NaHCO3 poudresolide → Na2CO3 anhydre + H2O gaz + CO2 gaz
Le bicarbonate de sodium est biodégradable et n'est toxique ni pour l'environnement, ni pour la santé[13]
Types de bicarbonate |

Bicarbonate de soude anglo-saxon « sans nom ».
Il existe trois types de bicarbonate de soude :
- technique,
- alimentaire,
- médicinal ou officinal.
Même si l'appellation est la même, les critères de pureté sont différents : on doit veiller à n'utiliser la qualité « technique » que pour un usage ménager. La qualité médicinale ou officinale est la plus fine et la plus pure. La qualité alimentaire est indiquée avec le code FCC et peut être utilisée pour tout emploi.
Dans le monde anglo-saxon, il est appelé baking soda.
Le bicarbonate de sodium (ou de soude) ne doit jamais être confondu avec les cristaux de soude (carbonate de sodium), ni avec la soude caustique (hydroxyde de sodium).
Utilisations |
Les avantages notables du bicarbonate de sodium sur les produits chimiques habituels sont sa sécurité, sa disponibilité et son faible coût[14].
Le bicarbonate a de très nombreuses utilisations[15].
Usage domestique |
Pour l'hygiène et les soins du corps |

Poudre de bicarbonate de sodium.
- pour les soins du visage : un gommage ou exfoliant doux du visage (en petits mouvements circulaires puis rincer), l'action étant assortie d'un assainissement de la peau ;
- comme dentifrice, comme agent de blanchiment des dents[16],[17], contre la plaque dentaire[18] et pour ses propriétés anti-caries[19] (valeur RDA de 7 donc non-abrasif[20]), seul ou mélangé à de l'argile, car il fonctionne comme un nettoyant mécanique sur les dents et les gencives ;
- en bain de bouche pour l'assainissement de la cavité buccale ou de ses plaies de muqueuses comme les aphtes (en tant qu'antiseptique)[21] ; il neutralise l'acidité de la bouche, et agit comme un antiseptique pour aider à prévenir les infections buccales[21], et pour lutter contre la mauvaise haleine, l'halitose (une petite cuillerée dans une tasse d'eau)[13] ;
- pour certains gargarismes (voir ci-dessus) ;
- pour l'hygiène des dreadlocks ;
- en shampoing, avec rinçage à l'eau ou à l'eau légèrement vinaigrée. Il est notamment utilisé dans le mouvement no poo, comme alternative aux shampoings chimiques et industriels[22] ;
- comme déodorant neutre sous les aisselles par son action anti-bactérienne (bactéries du genre Corynebacterium responsables des odeurs de transpiration[23])[24] ;
- pour le rasage ou l'épilation, une cuillerée de bicarbonate de sodium dans une tasse d’eau tiède appliquée avant et après rasage éteint le feu du rasoir[13].
Produit d'entretien à la maison |

« Comment entretenir une gazinière », Library of Congres, 1942
- Comme produit de nettoyage antibactérien, antimicrobien, antifongique, désinfectant, assainissant et antiviral (virucide) sur les surfaces de contact alimentaire[14],[25] ;
- Comme produit d'entretien de la maison et agent nettoyant de type poudre à récurer pour les émaux (baignoire, évier, lavabo...), les vitres intérieures de four, les casseroles brûlées, etc.
- Pour l'entretien du linge (adoucissant, assainissant[26] et détachant avant ou pendant lavage)[27] ;
- Comme désodorisant et antifongique, antimycosique pour les odeurs de transpiration des baskets, chaussures, vêtements ; contre les mauvaises odeurs des tapis et moquettes (juste à saupoudrer et laisser pauser), et des réfrigérateurs (dans une coupelle) ;
- Comme désodorisant anti-moisissures, il absorbe les odeurs de moisi des anciens placards et est une méthode fiable pour les vendeurs de livres d'occasion malodorants, assorti ensuite à une aération[28] ;
- Pour ôter les taches de thé ou café dans les tasses (dilué dans de l'eau chaude) ;
- Pour ôter la rouille de surface dans le cas de certaines oxydations[29];
- Comme agent actif pour déboucher des canalisations obturées[30] ;
- Comme adoucisseur d'eau pour réduire la dureté de l'eau (d'un bain ou d'une piscine, par exemple)[13] ;
- Pour lutter contre la croissance fongique, les parasites comme les acariens (saupoudrer la literie) ou tuer les cafards (saupoudrer les plinthes et autres trajets des insectes). Le bicarbonate de sodium est enregistré comme biopesticide par l'Environmental Protection Agency aux Etats-Unis[31].
Au garage[13] |
- Pour ôter les insectes, les gouttes de résine ou de sève sur la carrosserie ou les phares, une éponge imbibée de bicarbonate de sodium suffit et ne raye pas ;
- Pour ôter les mauvaises odeurs, saupoudrer de bicarbonate de sodium le cendrier, les sièges et les tapis (à ôter après quelques heures) ;
- Pour nettoyer et prolonger la vie des bornes sulfatées d’une batterie d'automobile, appliquer sur les bornes une pâte composée de 3/4 de bicarbonate et 1/4 d’eau, brosser, rincer, sécher puis enduire de vaseline ;
- Pour faire disparaître une tache d’huile sur le béton, saupoudrer de bicarbonate de sodium ;
Au jardin |
- Il peut être employé comme fongicide, par exemple, pour lutter contre l'oïdium et contre l'attaque de mildiou sur tomates. Le bicarbonate de soude permet d’atténuer l’acidité. En pulvérisant sur les feuilles un mélange de 1 cm3 de bicarbonate de sodium et 1 cm3 de savon noir dans un litre d'eau, leur surface devient moins acide et limiterait la capacité des spores de champignons à se développer.

Le Wacky cake : farine, sucre, cacao, bicarbonate de soude, huile végétale, vinaigre blanc, sel et vanille.
Usage alimentaire |
- Dans la fabrication des boissons et eaux gazeuses pour son rôle de générateur potentiel de gaz carbonique.
- Dans l'industrie alimentaire, c'est l'additif alimentaire numéro E500(ii)[32] ;
- Il est utilisé comme agent de levuration en tant que levure chimique pour un gâteau, prévoir une cuillère à café de bicarbonate pour 500 g de farine), anti-agglomérant ou comme régulateur de pH[33]. Ainsi comme agent gonflant dans les pâtes à crêpe, le pain ou d'autres aliments cuits au four ;
- Comme élément de panure pour qu'elle reste compacte et éviter qu'elle n'explose durant la friture ;
Dans la cuisine traditionnelle, il est l'élément de plusieurs recettes. Il est, entre autres, utilisé pour conserver leurs propriétés et leur couleur à certains légumes et légumineuses lors de la cuisson (une pincée), en raison de sa réaction avec la chlorophylle pour produire la chlorophylline[34] ;

Au Québec, le bicarbonate de sodium peut être appelé la « petite vache », en raison de l'image sur la boîte de bicarbonate de sodium vendue par la compagnie Cow Brand dans le passé.
- Pour faciliter le trempage des légumes secs comme pois, haricots, etc. (une pincée dans l'eau de trempage) ;
- L'ajout d'une pincée de bicarbonate permet également de monter facilement des blancs en neige ;
- Le bicarbonate de sodium, associé au chlorure de calcium, peut être employé dans les procédés de reminéralisation rapide des eaux trop faiblement minéralisées ou trop pures. Néanmoins, les teneurs en chlorure de calcium doivent être limitées à une valeur inférieure à 100 mg/litre pour ne pas rendre corrosives les eaux et altérer leur goût[35] ;
- Le bicarbonate de sodium et les eaux minérales qui en contiennent facilitent la digestion (voir ci-après).
Usage médical |
En médecine, il est utilisé en soluté de perfusion par voie intraveineuse, servant à l'alcalinisation des patients, notamment en cas d'acidose métabolique ou de l'hyperkaliémie[36]. Il ne fait cependant pas partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[37] ;

Sachet de bicarbonate de soude à utiliser avec un vaccin.
- Pour faciliter la digestion ou réduire les acidités gastriques en tant qu'antiacide (une petite cuillerée dans un verre d'eau)[13]. La pharmacopée l'a ainsi utilisée traditionnellement contre les maux d'estomac et pour calmer l'hyperchlorhydrie gastrique. Il était prescrit aussi pour le traitement des dyspepsies. À la Belle Époque, il est aussi considéré comme un médicament digestif, anti-acide et diurétique ;
- Pour soulager et traiter une réaction allergique aux plantes irritantes telles que le sumac ou le sumac vénéneux[38],[39] ;
- Contre les brûlures et les coups de soleil : passer sur la peau une pâte froide composée de bicarbonate de sodium avec un peu d’eau[13].
On notera que le bicarbonate de sodium n'a pas d'effet sur la pression sanguine sur certains rats déjà hypertendus ; il n'est pas hypertenseur[40].
Le bicarbonate de sodium, acteur principal de la régulation des milieux tampons de l'organisme, constitue l'essentiel de la réserve alcaline du plasma sanguin. Sa mobilisation, par exemple en réaction face à une acidose, permet de maintenir un pH constant. Sa concentration standard dans le plasma et le sang total est situé entre 22 et 26 milliéquivalents par litre.
Lutte contre les incendies |
Le bicarbonate de soude est utilisé pour éteindre un feu lorsque l'usage de l'eau est déconseillé, par exemple pour certains petits feux de friture ou de graisse[41]. Cependant, il ne doit pas être appliqué aux incendies dans les friteuses ; la libération soudaine du gaz peut causer des éclaboussures de graisse bouillante[42]. Le bicarbonate de sodium, générateur potentiel de gaz carbonique CO2, est présent dans les extincteurs d'incendie de classe B, contre les feux gras d'hydrocarbures liquides y compris l'essence, mais aussi les alcools et dérivés carbonyliques[43]. L'action d'une substance inerte, comme la terre, le sable ou le gaz carbonique, empêche le comburant d'atteindre le carburant, par étouffement du feu. On le trouve dans les liquides extincteurs, les mousses chimiques, et les poudres sèches anti-incendie.
- La réaction d'une solution aqueuse d'acide sulfurique sur une solution aqueuse de bicarbonate de sodium explique le dégagement rapide du gaz CO2, dans le liquide extincteur.
- La mousse chimique est générée par la réaction avec le sulfate d'aluminium, nécessairement en présence d'émulsifiant(s), soit :
- Al2(SO4)3 + 6 NaHCO3 poudre solide → 3 Na2SO4 + 2 Al(OH)3 + 6 CO2 gaz
La pression de projection du gaz permet une détente adiabatique de celui-ci, à effet refroidissant.
- Les poudres sèches anti-incendie sont à base de bicarbonate de sodium ou de bicarbonate de potassium. La chaleur de l'incendie permet de décomposer les composés cités légèrement impurs, à traces acides, mais stables à température ordinaire. Il se produit un dégagement d'eau vapeur et de gaz carbonique au contact du foyer ou de ses abords chauds. Les poudres bien répandues génèrent un effet de souffle, contrant la propagation de l'incendie.
Autres utilisations |
- Également utilisé dans la production agricole de la spiruline, par le développement de carbone.
Anodisation de l'aluminium.- Purification des fumées.
- Carburant propulsif pour fusée ludo-pédagogique lorsqu'il est mélangé avec du vinaigre.
- Agent de traitement anti-acariens.
- En modélisme, il est utilisé pour simuler de la neige en le mélangeant à de la colle PVA ou colle à bois.
Notes et références |
BICARBONATE DE SODIUM, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
« Sodium bicarbonate » dans la base de données Hazardous Substances Data Bank, consulté le 10 août 2010
Entrée de « Sodium hydrogen carbonate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 10 août 2010 (JavaScript nécessaire)
« Table thermodynamique à 298,15 K » (consulté le 21 mai 2017).
« Bicarbonate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
(el) Hérodote, Histoire - Livre II : Euterpe (lire en ligne), p. LXXXVI
Il est évident que la plupart des eaux rendues potables pour la consommation ne déposent pas de bicarbonate de sodium, pour la simple raison qu'elles ne sont ni aussi salées, ni dans une moindre mesure aussi hydrogénocarbonatées (ou bicarbonatées) que les eaux saumâtres des lacs des confins désertiques. À Paris et à Strasbourg, les concentrations moyennes en anion bicarbonate des eaux potables en 2010 sont respectivement de 220 et 247 mg/litre, alors que les concentrations en cation Na+ avoisinent 10 et 30 mg/litre.
Les premières analyses d'eaux minérales, reprises par la section chimie de l'Académie des sciences, à la fin du XVIIe siècle, l'ont trouvé en abondance dans l'eau minérale des sources Vichyssoises, il fait partie des sels minéraux.
Il s'agit du texte du 28 septembre 1581 lors son dernier retour vers Rome, avant son départ d'Italie. Le lieu de la source à un mille et demi de Viterbe abrite un logis de trois ou quatre bains. Il y a beaucoup de sources chaudes et de manifestations de volcanisme souterrain au centre de la péninsule italienne. L'auteur valétudinaire qui décrit avec une précision maladive depuis des jours les nombreux effets ressentis de douches, de bains et d'ingestion de diverses eaux, parfois trafiquées, en particulier de la contrée de Lucques en Toscane ne se soucie point de préciser la composition de cette écume.
Perry's Chemical Engineer Handbook.
Il faudrait exclure radicalement l'emploi de sels d'aluminium, par exemple de sulfate d'aluminium, encore communs dans les années 1990. Simple principe de précaution, de surplus en cuisine, car tous les sels d'Al3+ sont toxiques pour le monde vivant.
« Bicarbonate de sodium », sur Société chimique de France (consulté le 13 octobre 2018)
[International Journal of Food Microbiology] (en) Malk S. Yashpal, Goyal M. Sagar, « Virucidal efficacy of sodium bicarbonate on a food contact surface against feline calicivirus, a norovirus surrogate » [« Efficacité virucide du bicarbonate de sodium sur une surface de contact avec les aliments contre le calicivirus félin, un substitut de norovirus »], Vol. 109, sur Science direct, 25 mai 2006
"Le bicarbonate de soude: Maison - Cuisine - Santé - Beauté - 100% nature" par Nathalie Cousin - Rustica Editions - 64 pages
Le bicarbonate de soude est-il bon pour les dents ?, sur le site consoglobe.com, consulté le 19 mai 2016.
(en) Kleber, CJ ; Moore, MH ; Nelson, BJ (1998),"Laboratory assessment of tooth whitening by sodium bicarbonate dentifrices", The Journal of Clinical Dentistry, lire en ligne.
(en) Mankodi S., Berkowitz H., Durbin K., Nelson B., « Evaluation of the effects of brushing on the removal of dental plaque », sur PubMed.gov (US National Library of Medicine), 1998
(en) Storehagen, Silje; Ose, Nanna and Midha, Shilpi, « Dentifrices and mouthwashes ingredients and their use », Institutt for klinisk odontologi, Universitetet i Oslo
(en) Dentist Asheville | RDA (Relative Dentin Abrasivity) | Asheville Dentists Phillips & Schmitt, DDS, PA, consulté le 3 décembre 2015, le 13 octobre 2018.
(en) K. Iqbal et al., "Role of Different Ingredients of Tooth Pastes and Mouthwashes in Oral Health.," JPDA (Journal of Pakistan Dental Association) 20, no. 03 (Summer 2011): 164, accessed September 29, 2018.
« No-poo ou comment laver ses cheveux sans shampoing », sur lexpress.fr, 2015.
(en) James AG, Austin CJ, Cox DS, Taylor D, Calvert R, « », FEMS Microbiol Ecol, vol. 83, no 3, 2013, p. 527-40. (PMID 23278215, DOI 10.1111/1574-6941.12054)
(en) John Henderson Lamb, M.D., « Sodium bicarbonate : an excellent déodorant », The Journal of Investigation Dermatology, University of Oklahoma, 4 février 1946, p. 131-133 (lire en ligne)
(en) Rutala WA., Barbee SL., Aguiar NC., Sobsey MD., Weber DJ., « Antimicrobial activity of home disinfectants and natural products against potential human pathogens », sur PubMed (US National Library of Medicine), 21 janvier 2000(consulté le 13 octobre 2018)
Durant le projet Manhattan pour développer la bombe nucléaire au début des années 1940, la toxicité de l'uranium était un problème : de l'oxyde d'uranium ou des poussières toxiques de l'uranium appauvri restaient attachés aux vêtements malgré les lavages au savon ou au détergent ; le lavage avec du bicarbonate de sodium a permis un nettoyage efficace des vêtements contaminés ou en guise de prévention. Voir (en) Glen Lawrence, Department of Chemistry and Biochemistry, Long Island University, "Depleted Uranium and Health : Facts and Helpful Suggestions", Pharmacology and Toxicology of Uranium Compounds, 17 Janvier 2013, McGraw-Hill. Lire en ligne.
« Tache tenace : Comment enlever une tache sur mon T-shirt », 24 juillet 2016(consulté le 31 août 2016)
(en) Gail Altman, « How to Remove Odors from Books » [« Comment faire pour supprimer les odeurs de livres »], sur Book Think
Housecroft, Catherine E. et Sharpe, Alan G., Inorganic Chemistry, 3rd Edition, Pearson, 2008(ISBN 978-0-13-175553-6), « Chapter 22: d-block metal chemistry: the first row elements », p. 716
« déboucher ses canalisations naturellement avec du bicarbonate de soude », sur https://xn--dboucher-canalisation-b5b.fr (consulté le 9 août 2018)
(en) Registered biopesticides, 29/04/02, United States Environmental Protection Agency, lire en ligne.
Parlement européen et Conseil de l'Union européenne, « DIRECTIVE 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants du 20 février 1995 », Journal officiel, no L 61, 18 mars 1995, p. 1-56 (lire en ligne)
Codex Alimentarius (1989) Noms de catégorie et système international de numérotation des additifs alimentaires. CAC/GL 36-1989, p. 1-35.
Srilakshmi, B., Food Science, New Age International, 2003(ISBN 978-81-224-1481-3, lire en ligne), p. 188
La corrosion s'explique par des piqûres des ions chlorure en présence de micro-piles occasionnelles. Le procédé de reminéralisation le plus commode est basé sur l'injection de gaz carbonique CO2, associé à une percolation des eaux en présence de carbonate de soude Na2CO3 sur des lits de différents calcaires magnésiens, malheureusement parfois réduits en modules (CaO, MgO), avec ajustement du pH final. Finalement, le bicarbonate de sodium est formé in situ.
(en) « Sodium Bicarbonate Dosage Guide with Precautions - Drugs.com », sur www.drugs.com (consulté le 9 mars 2016)
WHO Model List of Essential Medicines, 18th list, avril 2013
« Comment vous débarrasser du sumac vénéneux », sur WikiHow
Nancy Desmarais (B. Pharm., Pharmacie Jean-François Martel), Julie Martineau (B. Pharm.,
Pharmacie Matte et Petit), « Le traitement des lésions causées par l’herbe à puces », volume 54, n° 8 d'août 2007, sur Québec pharmacie, 19 mai 2007
Theodore A. Kotchen, 2005), « Contributions of Sodium and Chloride to NaCl-Induced Hypertension ». Hypertension . 45 (5): 849-850. Lire en ligne.
« Comment éteindre les flammes sortant d'une friteuse ? », Consommer Durable, 24 septembre 2012(lire en ligne)
(en) "Arm & Hammer Baking Soda – Basics – The Magic of Arm & Hammer Baking Soda", armandhammer.com .
Rappel des codes : A pour feu sec (bois...), C pour feu de gaz...
Voir aussi |
.mw-parser-output .autres-projets ul{margin:0;padding:0}.mw-parser-output .autres-projets li{list-style-type:none;list-style-image:none;margin:0.2em 0;text-indent:0;padding-left:24px;min-height:20px;text-align:left}.mw-parser-output .autres-projets .titre{text-align:center;margin:0.2em 0}.mw-parser-output .autres-projets li a{font-style:italic}
Bibliographie |
- Martina Krčmár, Le bicarbonate, saveurs et vertus, Éd. Grancher
- Clémence Lefèvre, Les merveilleux pouvoirs du bicarbonate de soude, Éd. Exclusif, (ISBN 978-2-84891-083-3)
- Nicolas Palangié, Bicarbonate: un concentré d'astuces pour votre maison, votre santé, votre beauté, Éd. Eyrolles, (ISBN 978-2-212-55144-0)
- Inès Peyret, Le dictionnaire à tout faire du bicarbonate : 1001 usages pour le bicarbonate..., Dauphin, Paris, 2012, 271 pages, (ISBN 978-2-7163-1473-2)
Articles connexes |
- Carbonate de sodium
- Bicarbonate
- Bicarbonate d'ammonium
- Levure chimique
- Fusée au bicarbonate de sodium
- Sels minéraux de Vichy
Liens externes |
- Présentation du produit sur le site societechimiquedefrance.fr
- Portail de la chimie
- Portail de la pharmacie
- Portail de l’hématologie
vVd1h9,9X,raUoLWt



