Chimie

Multi tool use

La structure chimique de l'ADN
La chimie est une science de la nature qui étudie la matière et ses transformations, et plus précisément[1] :
- les éléments chimiques à l'état libre, atomes ou ions atomiques. Elle étudie également leurs associations par liaisons chimiques qui engendrent notamment des composés moléculaires stables ou des intermédiaires plus ou moins instables. Ces entités de matière peuvent être caractérisées par une identité reliée à des caractéristiques quantiques et des propriétés précises ;
- les processus qui changent ou modifient l'identité de ces particules ou molécules de matière, dénommés réaction chimique, transformation, interaction, etc. ;
- les mécanismes réactionnels intervenant dans les processus chimiques ou les équilibres physiques entre deux formes, qui permettent d'interpréter des observations et d'envisager de nouvelles réactions ;
- les phénomènes fondamentaux observables en rapport avec les forces de la nature qui jouent un rôle chimique, favorisant les réactions ou synthèses, addition, combinaison ou décomposition, séparation de phases ou extraction. L'analyse permet de découvrir les compositions, le marquage sélectif ouvre la voie à un schéma réactionnel cohérent dans des mélanges complexes.
La taille des entités chimiques varie de simples atomes ou molécules nanométriques aux édifices moléculaires de plusieurs dizaines de milliers d'atomes dans les macromolécules, l'ADN ou protéine de la matière vivante (infra)micrométrique, jusqu'à des dimensions parfois macroscopiques des cristaux. En incluant l'électron libre (qui intervient dans les réactions radicalaires), les dimensions de principaux domaines d'application se situent dans son ensemble entre le femtomètre (10−15 m)[2] et le micromètre (10−6 m).
L'étude du monde à l'échelle moléculaire soumise paradoxalement à des lois singulières, comme le prouvent les récents développements nanotechnologiques, permet de mieux comprendre les détails de notre monde macroscopique. La chimie est qualifiée de « science centrale »[3] en raison des puissants liens qu'elle possède avec la biologie et la physique. Ainsi qu'avec la médecine, la pharmacie, l'informatique et la science des matériaux, sans oublier des domaines appliqués tels que le génie des procédés.
La physique, et surtout son instrumentation, est devenue hégémonique après 1950 dans le champ de la science de la matière. Les avancées en physique ont surtout refondé en partie la chimie physique et la chimie inorganique. La chimie organique, par l'intermédiaire de la biochimie, a partagé des recherches valorisant la biologie. Mais la chimie n'en garde pas moins une place incontournable et légitime dans le champ des sciences exactes : elle fournit des produits, des molécules, découvre ou invente des structures moléculaires simples ou complexes qui bénéficient de façon extraordinaire à la recherche physique ou biologique. Enfin, l'héritage cohérent que les chimistes défenseurs marginaux des structures atomiques ont légué aux acteurs de la révolution des conceptions physiciennes au début du XXe siècle ne doit pas être sous-estimé.

Tubes à essai contenant des solutions et des précipités.
Sommaire
1 Étymologie et Histoire
1.1 Étymologie
1.2 Origines
1.3 Évolution avant l'apparition d'une science mécaniste
1.4 Représentations de l'atome et de la molécule
1.5 Méthodes physiques d'identification de composés chimiques au XXe siècle
1.6 Quelques personnalités de la chimie et de la physico-chimie
2 Disciplines
3 Concepts fondamentaux
3.1 Structure de la matière
3.1.1 Élément
3.1.2 Atome
3.1.2.1 Isotope
3.1.3 Molécule
3.1.4 Liaison chimique
3.1.5 Corps pur
3.1.6 Composé chimique
3.1.7 Ion
3.1.8 Complexe
3.2 Quantité de matière et mole
3.3 Chimie expérimentale
3.4 Réaction chimique
3.4.1 Solution et émulsion
3.4.2 Oxydoréduction et électrochimie
3.4.3 Acide et base
3.4.4 Synthèse chimique
3.4.4.1 Chimie des polymères
3.5 Lois chimiques
4 Enseignement
4.1 France
4.2 Québec
4.3 Suisse
5 Industrie
6 Recherche
6.1 Institutions ou associations nationales et sociétés professionnelles
6.2 Prix
7 Applications et toxicologie
7.1 De la chimie en bien et en mal
7.2 Santé et environnement
7.3 Risques et réglementation
8 La chimie fantasmée
8.1 Littérature
9 Notes et références
10 Voir aussi
10.1 Articles connexes
10.2 Bibliographie
10.2.1 Ouvrage de découverte
10.2.2 Une science expérimentale
10.2.3 Enseignement général, initiation ou formation à quelques spécialités de la chimie
10.2.4 Revues, handbook et traités encyclopédiques
10.2.5 Histoire et ouvrages jalons d’une époque
10.3 Liens externes
Étymologie et Histoire |
Étymologie |
Trois étymologies sont fréquemment citées, mais ces hypothèses peuvent être reliées :
- l'une égyptienne, kemi viendrait de l'ancien égyptien Khemet, la terre. Il se retrouve aussi dans le copte chame « noire » puisque dans la vallée du Nil, la terre est noire. L'art de la kemi, par exemple les poisons minéraux, a pu influencer la magie noire. La terre d'Égypte elle-même aurait été fort anciennement une terre conquise par des peuples noirs[4] ;
- la racine grecque se lie à χυμεία, khumeia, « mélange de liquides » (χυμός, khumos, « suc, jus »)[5] ;
- enfin, le mot « chimie » proviendrait de l'arabe al kemi, الكيمياء (littéralement la kemia, la « chimie »[6]), venant du grec χεμεία, khemeia, qui signifie « magie noire », mot lui-même venant de l'égyptien ancien kem qui désigne la couleur noire.
Notes
Al kem signifie aujourd'hui en arabe 'la quantité', attestant que la chimie passe par une précoce approche quantitative de la matière, couvrant indistinctement le champ des premiers procédés chimiques comme celui du dosage en pharmacopée.
Khem(et) désigne la terre pour les anciens Égyptiens. La chimie se présente comme l'art de la terre et le savoir sur la terre.- En persan, « Kimiya », « kimyaw » ou « Kamyâb » pour les Iraniens d'aujourd'hui, signifie rare. Rhazès (Razi), l'alchimiste perse du IXe siècle, cherchait à obtenir un élément rare capable de transformer les métaux en or.
Origines |
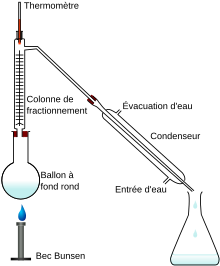
Schéma de distillation au laboratoire.
La distillation fractionnée sert à séparer des corps chimiques de différentes volatilités. Le recueil méticuleux de phases vapeur semble l'une des plus anciennes opérations chimiques connues.
L'art d'employer ou de trier, préparer, purifier, de transformer les substances séchées mises sous forme de poudres, qu'elles proviennent du désert ou de vallées sèches, a donné naissance à des codifications savantes. Initialement d'abord essentiellement minérales. Mais les plantes éphémères et les arbres pérennes du désert, et leurs extraits gommeux ou liquides nécessaires aux onguents ont été très vite assimilés à celles-ci, par reconnaissance de l'influence des terres et des roches.
Outre la connaissance du cycle de l'eau et des transports sédimentaires, la maîtrise progressive des métaux et des terres, les Anciens Égyptiens connaissent beaucoup de choses. Parmi elles, le plâtre, le verre, la potasse, les vernis, le papier (papyrus durci à l'amidon), l'encens, une vaste gamme de couleurs minérales ou pigments, de remèdes et de produits cosmétiques, etc. Plus encore que les huiles à onction ou les bains d'eaux ou de boues relaxants ou guérisseurs, la chimie se présente comme un savoir sacré qui permet la survie. Par exemple par l'art sophistiqué d'embaumer ou par le placement des corps des plus humbles dans un endroit sec.
L'art de la terre égyptien a été enseigné en préservant une conception unitaire. Les temples et les administrations religieuses ont préservé et parfois figé le meilleur des savoirs. Le pouvoir politique souverain s'est appuyé sur les mesures physiques, arpentage et hauteur hydraulique des crues, peut-être sur la densité du limon en suspension, pour déterminer l'impôt et sur les matériaux permettant les déplacements ou la mobilité des armées. Le vitalisme ou les cultes agraires et animaux, domaines appliqués de la kemia, ont été préservés dans des temples, à l'instar d'Amon, conservatoire des fumures azotées et de la chimie ammoniacale antique.
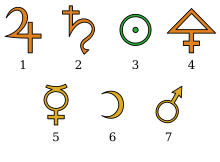
Signes alchimiques des sept métaux : Étain (Jupiter), Plomb (Saturne), Or (Apollon, soleil), Cuivre (Vénus), Mercure, Argent (Diane, Lune), Fer (Mars).
Les savants musulmans[7] supposaient que tous les métaux provenaient de la même espèce. Ils croyaient à la possibilité de la transmutation et cherchèrent en vain dans cette perspective l'obtention de « l'al-iksir » qui prolongerait la vie.
- « Dans le même temps, guidés par des préoccupations plus pratiques, ils se livraient dans leurs laboratoires à des expérimentations systématiques des corps. Disposant de tableaux indiquant les poids spécifiques, ils pouvaient en les pesant, les distinguer, les reconnaître par des analyses sommaires et, quelquefois même les reconstituer par synthèse. [...] Ils trouvèrent des teintures pour colorer les tissus, les mosaïques et les peintures, si parfaites qu'elles ont gardé leur fraîcheur millénaire. »
- « Les Arabes allaient faire connaître au monde l'usage des parfums, en apprenant à extraire les parfums des fleurs. À Chapur, on distillait toutes les essences selon les techniques zoroastriennes : narcisse, lilas, violette, jasmin… Gur était réputé pour ses eaux parfumées et fabriquait des eaux de fleur d'oranger et de rose à base de rose d'Ispahan. Samarkand était célèbre par son parfum de basilic, Sikr par son ambre. Le musc du Tibet, le Nénuphar d'Albanie, la Rose de Perse demeurent des parfums aussi prestigieux que légendaires. »
- « En mélangeant la soude (Al-qali) avec le suif ou l'huile, les Arabes fabriquèrent les premiers savons et créèrent une des plus magnifiques industries de Bagdad, qui devait s'étendre rapidement sur l'Égypte, la Syrie, La Tunisie et l'Espagne musulmane. L'islam avait fait si bien que le goût du bien-être gagna toutes les classes de la société et que la production ne suffit plus à la consommation. Le besoin d'inventer l'industrie des succédanés ou ersatz se fit sentir à ce moment-là »[8] »
Nos repères de pensée taxonomique sont profondément influencés par les civilisations grecques puis hellénistiques, férues de théorisations, qui ont lentement esquissé de façon sommaire ce qui encadre aux yeux profanes la chimie, la physique et la biologie. Elles ont laissé les techniques vulgaires au monde du travail et de l'esclave. L'émergence de spiritualités populaires, annexant l'utile à des cultes hermétiques, a promu et malaxé ses bribes de savoirs dispersés. Incontestablement, les premiers textes datés tardivement du Ier siècle et IIe siècle après Jésus-Christ comportent à l'exemple de l'alchimie médiévale la plus ésotérique, une partie mystique et une partie opératoire[9]. La religiosité hellénistique a ainsi légué aussi bien le bain-marie, de Marie la Juive que l'abscons patronage d'Hermès Trismégiste, divinité qui prétendait expliquer à la fois le mouvement et la stabilité de toute chose humaine, terrestre ou céleste.
Évolution avant l'apparition d'une science mécaniste |
Au cours des siècles, ce savoir empirique oscille entre art sacré et pratique profane. Il s'est préservé comme l'atteste le vocable chimia des scolastiques en 1356, mais savoir et savoir-faire sont souvent segmentés à l'extrême. Parfois, il est amélioré dans le monde paysan, artisan ou minier avant de devenir une science expérimentale, la chimie, au cours des troisième et quatrième décennies du XVIIe siècle. Au même titre que la physique, le prodigieux essor de la pensée et de la modélisation mécanistes, font naître la chimie sous forme de science expérimentale et descriptive[10]. Riche de promesses, la chimie reste essentiellement qualitative et bute sur le retour incessant des croyances écartées.
Les alchimistes ont subsisté jusqu'en 1850. Ils étaient acceptés par les croyances communes, poursuivant la quête de la pierre philosophale et continuant l'alchimie sous une forme ésotérique. La rupture entre la chimie et l'alchimie apparaît pourtant clairement en 1722, quand Étienne Geoffroy l'Aîné, médecin et naturaliste français, affirme l'impossibilité de la transmutation. La chimie expérimentale et l'alchimie diffèrent déjà radicalement ; donc il devient nécessaire de pouvoir distinguer ces deux termes restés dans le langage.
La chimie a connu une avancée énorme avec Antoine Lavoisier qui l'a promue au rang de science exacte. Lavoisier reste dans l'Histoire comme celui qui a découvert la combustion par le dioxygène (1775). Pour le philosophe Thomas Samuel Kuhn, il s'agit une révolution scientifique majeure, qui a donné naissance à la chimie moderne[11].
Les biographies des savants français et étrangers se trouvent dans les articles répertoriés dans la Catégorie:Chimiste ou de la Liste de chimistes.
Représentations de l'atome et de la molécule |

John Dalton à son modeste bureau de laboratoire mancunien.
L'étude qualitative de la matière a naturellement conduit les premiers chimistes des années 1620-1650 à modéliser sa composition, puisant librement, mais non sans méfiance dans une abondante tradition antique. À la suite de Van Helmont, ces adeptes mécanistes de la contingence maîtrisent déjà la notion de gaz, tiennent compte du facteur de la température et parviennent à expliquer sommairement la pression de vapeur d'un corps et les mélanges miscibles des fluides. John Dalton, persévérant expérimentateur, continuateur de la première lignée mécaniste partiellement abandonnée, a le premier essayé de donner une définition moderne de la notion d'atome. L'atome constitue une particule fondamentale ou une combinaison de plusieurs d'entre elles. En 1811, Amedeo Avogadro affirme que le volume d'un gaz quelconque à pression et température constante contient le même nombre de particules, qu'il dénomme molécules intégrantes ou constituantes[12].
L'obstination de nombreux chimistes souvent incompris, tel Berzelius en pionnier de l'électrovalence dès 1812, a servi pour réaffirmer la possibilité d'une modélisation à la fois mécaniste et géométrique par le biais d'une architecture atomique. Auguste Laurent, proposant pour des séries homologues de molécules organiques un même squelette constitué d'atomes, était cruellement dénigré par les maîtres des laboratoires[13]. Mais malgré la suprématie et l'influence politique des équivalentistes, le revirement s'opère. Ce dernier est porté par la reconnaissance des vieux succès de l'électrochimie préparative depuis Humphry Davy et Michael Faraday et la volonté de corréler quantitativement nombre d'espèces chimiques et masse d'un corps pur.

Représentation de l'atome d'oxygène selon le modèle de Bohr : autour du noyau, les électrons en orbite.
Le congrès de Karlsruhe organisé en 1860 par les amis de Friedrich August Kékulé von Stradonitz et de Charles Adolphe Wurtz ouvre la voie à des conventions atomiques[14]. Son influence éveille une intense recherche de classification des éléments qui débouche notamment sur les classifications périodiques de Mendeleïev et de Meyer. Elle entraîne un renouveau d'intérêt pour les molécules[15]. Kékulé et Kolbe en chimie organique, Le Bel et van 't Hoff en chimie générale et plus tard Alfred Werner en chimie minérale établissent les fondements de la représentation en structures moléculaires[16].

Les orbitales atomiques représentées par les nuages électroniques probabilistes et modélisées à l'aide des équations de la mécanique quantique, le meilleur outil théorique actuel pour décrire le comportement des liaisons quantifiées des atomes et molécules.
Les travaux de Joseph John Thomson, découvreur de l'électron en 1897, prouvent que l'atome est constitué de particules électriquement chargées. Ernest Rutherford démontre par sa célèbre expérience en 1909 que l'atome est surtout composé de vide, son noyau, massif, très petit et positif, étant entouré d'un nuage électronique. Niels Bohr, précurseur de la modélisation atomique, affirme en 1913 que les électrons circulent sur des « orbites ». Lorsque James Chadwick découvre les neutrons, la théorie quantique fondée au début de l'entre-deux-guerres sur le modèle rival d'Erwin Schrödinger renforcée par les compléments matriciels de Werner Heisenberg, l'affinement théorique de Wolfgang Pauli a déjà pris son envol. Et ce, malgré les contestations appliquées et systématiques d'Albert Einstein. Des années 1930 à notre XXIe siècle, la mécanique quantique explique le comportement de l'atome et des molécules.
Méthodes physiques d'identification de composés chimiques au XXe siècle |

Un spectromètre de masse.
Au XXe siècle, l'essor des mesures physiques a facilité aux chimistes la caractérisation des composés avec lesquels ils travaillent. Auparavant, la réaction chimique et un nombre restreint de techniques physico-chimiques s'imposaient en ultime recours pour détecter ou caractériser une molécule. Maintenant, il existe diverses méthodes de mesures. Parmi elles, la chromatographie, la spectrométrie électromagnétique (infrarouge, lumière visible ou UV), la masse, de résonance magnétique nucléaire. Sans oublier aussi d'inclure les microscopies électroniques et autres analyses par diffraction de rayons X ou par diffusion de particules et, dans des cas d'observation contrôlée sur surface plane, la microscopie par champ de force. Toutes ces possibilités ont permis une identification plus aisée. Elles offrent souvent la possibilité de remonter à la structure géométrique des molécules et de leurs assemblages et de connaître leur composition isotopique. Parfois même de « voir » par le multiplicateur instrumental la molécule, de la (dé)placer ou de suivre des réactions (photo)chimiques en temps réel de plus en plus brèves. Ces progrès physico-chimiques ont permis de grandes avancées tout particulièrement en biochimie où les édifices étudiés restent complexes et les réactions variées.
Quelques personnalités de la chimie et de la physico-chimie |
| Nom |
Pays |
Contribution |
Distinctions |
|---|---|---|---|
Svante August Arrhenius (1859-1927) |
Loi d'Arrhenius |
Prix Nobel de chimie 1903 |
|
Amedeo Avogadro (1776-1856) |
Définition de la mole |
||
Johann Joachim Becher (1635-1682) |
Précurseur de la chimie scientifique |
||
Henri Becquerel (1852-1908) |
Découverte de la radioactivité |
Prix Nobel de physique 1903 |
|
Marcellin Berthelot (1827-1907) |
Pionnier de la thermochimie |
Médaille Davy 1883 |
|
Niels Bohr (1885-1962) |
Modèle de Bohr de l'atome |
Prix Nobel de physique 1922 |
|
Joannes Brønsted (1879-1947) |
Théorie acido-basique |
||
Donald J. Cram (1919-2001) |
Travaux en stéréochimie |
Prix Nobel de chimie 1987 |
|
John Dalton (1766-1844) |
Théorie atomique |
||
John Frederic Daniell (1790-1845) |
Pile Daniell |
||
Emil Fischer (1852-1919) |
Projection de Fischer |
Prix Nobel de chimie 1902 |
|
Jacobus Henricus van 't Hoff (1852-1911) |
Cinétique chimique, équilibres chimiques, pression osmotique |
Prix Nobel de chimie 1901 |
|
Frédéric Joliot-Curie (1900-1958) Irène Joliot-Curie (1897-1956) |
Radioactivité artificielle |
Prix Nobel de chimie 1935 |
|
Friedrich Kekulé von Stradonitz (1829-1896) |
Structure cyclique du benzène |
Médaille Copley 1885 |
|
Antoine Lavoisier (1743-1794) |
Loi de conservation de la masse |
||
Dmitri Mendeleïev (1834-1907) |
Tableau périodique des éléments |
Médaille Davy 1882 |
|
Walther Nernst (1864-1941) |
Équation de Nernst, Troisième principe de la thermodynamique |
Prix Nobel de chimie 1920 |
|
Wilhelm Ostwald (1853-1932) |
Empire russe |
Catalyse et équilibres chimiques, vitesse de réaction |
Prix Nobel de chimie 1909 |
Linus Pauling (1901-1994) |
Théories sur la nature de la liaison chimique |
Médaille Davy 1947 Prix Nobel de chimie 1954 |
|
Ernest Rutherford (1871-1937) |
Travaux sur la radioactivité, modèle de l'atome compact |
Prix Nobel de chimie 1908 |
Disciplines |
La chimie est divisée en plusieurs spécialités expérimentales et théoriques à l'instar de la physique et de la biologie, avec lesquelles elle partage parfois des espaces d'investigations communs ou proches.
La recherche et l'enseignement en chimie sont organisés en disciplines qui peuvent partager des domaines communs :
- la biochimie qui étudie les réactions chimiques dans des milieux biologiques (cellules…) ou avec des objets biologiques (protéines…) ;
- la chimie analytique regroupe l'étude des méthodes d'analyses qualitatives ou quantitatives qui permettent de connaître la composition d'un échantillon donné ; la chromatographie et la spectroscopie en constituent ses principaux domaines ;
- la chimie des matériaux présente la préparation et l'étude de substances avec une application en tant que matériau. Ce domaine intègre des éléments des autres domaines classiques de la chimie avec un intérêt particulier pour les problèmes fondamentaux concernant les matériaux ;
- la chimie inorganique ou chimie minérale concerne la description et l'étude des éléments chimiques et des composés sans squelette carboné ;
- la chimie organique recense la description et l'étude des composés comportant un squelette d'atomes de carbone (composés organiques) ;
- la chimie physique dont l'objet constitue l'étude des lois physiques des systèmes et procédés chimiques ; ses principaux domaines d'étude comprennent : la thermochimie, la cinétique chimique, l'électrochimie, la radiochimie, et les spectroscopies ;
- la chimie théorique analyse l'étude de la chimie à travers un raisonnement théorique fondamental (habituellement à l'aide des mathématiques et de la physique). En particulier, l'application de la mécanique quantique à la chimie a donné naissance à la chimie quantique. Depuis la fin de la Seconde Guerre mondiale, le progrès des ordinateurs a permis le développement de la chimie numérique (ou computationnelle).
Liste d'autres domaines spécialisés ou d'interface :
- agrochimie
- astrochimie
- catalyse homogène
- catalyse hétérogène
- carbochimie
- chimie de l'atmosphère terrestre et de la haute atmosphère
- chimie bioinorganique
- chimie du carbone
- chimie environnementale
- chimie industrielle
- chimie médicinale
- chimie nucléaire
- chimie organométallique
- chimie des argiles et zéolithes
- chimie de la combustion et des milieux plasma
- chimie des polymères
- chimie des sucres
- chimie des surfaces
- chimie des solutions
- chimie de synthèse
- chimie radicalaire
- chimie supramoléculaire
- chimie verte
- électrochimie
- génie chimique
- géochimie
- immunochimie
- microchimie
- nanotechnologie
- pétrochimie
- pharmacologie
- photochimie
- phytochimie
- topochimie
- tribologie
- sonochimie
Ces interfaces mouvantes ne facilitent pas la délimitation de la chimie.
- Avec la physique.
- Bien que la frontière entre la physique et la chimie ne soit pas clairement définie, elle est considérée, généralement, comme relevant de la chimie car les phénomènes provoqués par les réactions entre les constituants de la matière entraînent une modification des liaisons entre les atomes. Selon la nature de ces liaisons, ces phénomènes impliquent entre les atomes des échanges ou mises en commun d'électrons ou bien des forces électrostatiques. Les niveaux d'énergie mis en œuvre dans les phénomènes chimiques font que, au-delà, on entre dans la physique des plasmas, voire dans la physique nucléaire avec l'implication du noyau atomique. Aux échelles inférieures à celle de l'atome, l'étude des particules élémentaires et de leurs interactions relève de la physique des particules.
- Avec la biologie.
- La frontière entre la chimie et la biologie n'est pas plus clairement définie. En effet, la délimitation n'est pas bien définie entre la biochimie et la biologie moléculaire. La biochimie constitue une sous-discipline de la chimie qui étudie les réactions chimiques dans des milieux biologiques (cellules…) ou avec des objets biologiques (protéines et autres biomolécules…). La biologie moléculaire, quant à elle regroupe la partie de la biologie qui s'intéresse à la compréhension des processus biologiques au niveau moléculaire.
- Avec la science des matériaux.
- L'omniprésence de la chimie se retrouve lorsqu'on considère les fondements du domaine initialement technologique des matériaux. Mais ce dernier tend à prendre par hyperspécialisation une distance envers sa matrice, et cette toile de fond n'apparaît souvent que lors des évolutions techniques. Ainsi l'art de la dentisterie en mutation dans les années 1980-1990 a pu se réaliser grâce aux applications de la chimie macromoléculaire.
L'évolution de la chimie, tant dans son enseignement que dans les champs de recherche, est influencée à terme par les puissantes directions de recherches américaines. En particulier de façon récente privilégiant majoritairement les domaines des soins et de la santé humaine et animale[réf. nécessaire].
La langue de la recherche en chimie se présente majoritairement en anglais. Des années 1880 à la Grande Guerre, l'allemand, l'anglais et le français ont pourtant constitué des langues véhiculaires nécessaires aux savants. Mais survient l'éclipse du français dans l'entre-deux-guerres[17]. Puis l'allemand, qui avait réussi à préserver quelques dernières revues importantes ou écrits scientifiques de référence, a cédé face à l'anglais dans les années 1990.
Concepts fondamentaux |
Structure de la matière |
Élément |
Un élément est une entité immatérielle dénuée de propriétés physiques ou chimiques. Il constitue un couple formé d'un symbole et d'un numéro atomique (numéro d'ordre dans le tableau périodique des éléments) qui caractérise les atomes, molécules, ions, nucléides isotopes d'une espèce chimique donnée. 92 éléments naturels et 17 éléments artificiellement créés par l'homme sont répertoriés.
Un élément chimique désigne abstraitement l'ensemble des atomes avec un nombre donné de protons dans leur noyau[18]. Ce nombre s'appelle le numéro atomique. Par exemple, tous les atomes avec six protons dans leurs noyaux constituent des atomes de l'élément carbone C. Ces éléments sont rassemblés et ordonnés dans le tableau périodique des éléments.
Atome |
L'atome (grec ancien ἄτομος [atomos], « indivisible »)[19] d'une espèce chimique représente une entité matérielle. L'atome est formé d'un noyau atomique contenant des nucléons, en particulier d'un nombre Z de charge électrique élémentaire positive du noyau qui maintient autour de lui un nombre d'électrons, charge négative équilibrant la charge positive du noyau. Il possède un rayon, une structure géométrique, ainsi que des propriétés chimiques et physico-chimiques spécifiques relevant de ce cortège électronique.
Un atome constitue la plus petite partie d'un corps simple pouvant se combiner chimiquement avec une autre. Généralement constitué d'un noyau composé de protons et de neutrons autour desquels orbitent des électrons, sa taille caractéristique se compte en dixième de nanomètre (nm), soit 10-10 m.
La théorie atomiste, qui soutient l'idée d'une matière composée de « grains » indivisibles (contre l'idée d'une matière indéfiniment sécable), est connue depuis l'antiquité, et fut en particulier défendue par Démocrite, philosophe de la Grèce antique. Elle fut disputée jusqu'à la fin du XIXe siècle ; aujourd'hui, cela ne fait l'objet d'aucune controverse. Les sciences de la matière modernes se reposent en particulier sur cette notion d'atome. L'atome n'est cependant plus considéré comme un grain de matière insécable, depuis les expériences de physique nucléaire ayant mis à jour sa structure au début du XXe siècle.
En chimie, les atomes représentent les éléments de base. Ils constituent la matière et forment les molécules en partageant des électrons. Les atomes restent grosso modo indivisibles au cours d'une réaction chimique (en acceptant les légères exceptions que constituent les échanges des électrons périphériques).
Cependant, depuis le début du XXe siècle, des expériences de physique nucléaire ont mis en évidence l'existence d'une structure complexe pour le noyau atomique. Les constituants de l'atome constituent des particules élémentaires.
Les plus gros atomes peuvent être vu au microscope électronique en transmission
Histoire de l'atome
Le concept d'atome est particulièrement bien admis par le grand public, pourtant, paradoxalement, les atomes ne peuvent pas être observés par des moyens optiques et seuls quelques rares physiciens manipulent des atomes isolés. L'atome représente donc un modèle essentiellement théorique. Bien que ce modèle ne soit plus aujourd'hui remis en cause, il a beaucoup évolué au cours du temps pour répondre aux exigences des nouvelles théories physiques et correspondre avec les différentes expérimentations effectuées.
Isotope |
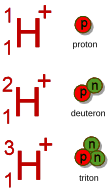
Les trois isotopes de l'hydrogène, seul élément pour lequel on réserve un nom particulier à ses isotopes nettement plus massifs deutérium et tritium.
Un isotope d'une espèce atomique constitue une entité matérielle caractérisée par :
- le symbole de son élément, le nombre Z qui représente aussi le numéro atomique ;
- le nombre de masse A qui représente la masse relative de l'isotope, A = Z + N.
Un isotope possède des propriétés nucléaires spécifiques. Les propriétés chimiques des divers isotopes ne diffèrent pas entre elles pour les atomes suffisamment lourds.
Molécule |

Modèle éclaté simplifié de la molécule d'eau H2O. Un atome d'oxygène arbitrairement en rouge s'est accolé deux atomes d'hydrogène arbitrairement en blanc. L'angle est respecté, mais non les tailles relatives des nuages électroniques.
Une molécule constitue un assemblage précis d'atomes, domaine défini et structuré dans l'espace et le temps par des liaisons chimiques fortes[20]. Une molécule polyatomique se comporte essentiellement comme une entité aux propriétés propres, une individualité chimique radicalement différente des atomes qui composent son architecture. Si les molécules monoatomiques ou les petites molécules polyatomiques sont électriquement neutres, les molécules plus grandes ou complexes n'obéissent pas systématiquement à ce critère.
Liaison chimique |
La liaison chimique impliquant la présence d'électrons liés à un ou plusieurs noyaux explique la réalité moléculaire[21]. Plus précisément, elle assure la stabilité des molécules et, dans le cas d'un assemblage complexe, la cohésion liante de chaque atome entre eux mettant en jeu par échange ou partage un ou plusieurs électrons dans les liaisons covalentes. Cela se réalise par la mise en commun d'électrons collectifs à un vaste réseau d'atomes dans la liaison métallique ou initiant par de fortes dissymétries locales de charges, des forces électrostatiques.
Corps pur |

Soufre cristal jaune sur un minerai sicilien de l'Etna.
Un corps pur incarne un corps généralement macroscopique constitué au niveau moléculaire d'une seule espèce chimique[22]. Sa composition chimique, son organisation sous forme de gaz, liquide, solide amorphe ou réseaux cristallins, etc., et ses propriétés physiques, par exemple les constantes physiques correspondant aux transitions de premier ordre comme la température de fusion, d'ébullition, peuvent être définies. En particulier, l'analyse chimique distingue les corps simples, dont l'espèce chimique est constituée d'atomes de mêmes éléments, des corps composés, dont l'espèce chimique est constituée d'atomes d'éléments différents[23].
Composé chimique |
Un composé chimique désigne l'espèce chimique d'un corps composé.
Un corps pur est caractérisé par sa formule chimique, écriture symbolique plus ou moins complexe et détaillée, de sa composition chimique. La masse molaire d'un corps pur correspond à la masse d'un nombre d'Avogadro (6,022 × 1023) d'ensembles correspondants à sa formule brute. Cela concerne la molécule pour les composés moléculaires, les ions constituants les solides ioniques, l'atome dans le cas des gaz rares ainsi que dans celui des métaux et des solides covalents.
Ion |
Un ion représente un atome qui a perdu ou gagné un ou plusieurs électrons. Il s'agit un cation simple lorsque son cortège électronique a été privé d'un ou plusieurs électrons, il est chargé positivement. Il constitue un anion simple lorsque son cortège électronique s'en trouve excédentaire, il est alors chargé négativement. Les anions ou cations formés à partir de molécules polyatomiques sont appelés ions complexes.
Complexe |

Un ion potassium complexé et inclus dans un cryptand. Les cryptands, représentent des molécules de synthèse comportant des cavités susceptibles de retenir et piéger un ion étranger. L'ensemble forme un cryptate, molécule complexe qui permet ainsi la dissolution de solides ioniques en solvant organique.
Les complexes sont des édifices formés par un élément central et des ligands. L'élément central, souvent un ion métallique avec un complexe pouvant être chargé. L'étude des complexes métalliques relève de la chimie organométallique ou de la chimie de coordination suivant la nature de l'atome lié au métal (respectivement, un carbone, ou un autre atome). Les complexes revêtent une grande importance en chimie des solutions, en catalyse et en chimie bioinorganique.
Quantité de matière et mole |
Dans les conditions habituelles au laboratoire, le nombre d'entités chimiques participant à une réaction est très élevé : pour une masse de l'ordre de la dizaine de grammes de matière, Il se rapproche de 1023.
Les chimistes utilisent communément une unité numérique, la mole, qui est représentée par la lettre minuscule « n ». La grandeur associée à la mole constitue la quantité de matière. Une mole d'une entité chimique précise implique l'égalité du nombre de ses particules au nombre d'Avogadro 6,02 × 1023. Ce dernier nombre est défini par convention comme le nombre d'atomes de carbone présents dans 12 g de 12C, c'est-à-dire, un atome de carbone contenant six neutrons et six protons.
La masse molaire M d'un corps pur moléculaire correspond à la masse d'une mole de molécules de celui-ci et s'exprime en grammes par mole (g•mol-1). La connaissance de la formule chimique et des masses molaires atomiques permet le calcul de la masse molaire moléculaire.
Une mole de gaz parfait occupe 22,4 L dans les conditions normales de température et de pression (0 °C ou 273 K, 101,3 kPa).
Chimie expérimentale |
L'aspect expérimental reste central en chimie, ceci aussi bien du point de vue historique que pour la pratique actuelle de cette science ainsi que de son enseignement. Les activités en chimie expérimentale peuvent se résumer essentiellement en quatre fonctions dont les contours exacts dépendent du contexte dans lequel elles sont réalisées (enseignement, recherche, industrie dans un certain domaine spécifique de la chimie)[24],[25] :
extraire, c'est-à-dire séparer sélectivement un ou plusieurs composés d'un mélange sur la base de leurs propriétés chimiques ou physiques ;
purifier, c'est-à-dire isoler une substance sélectionnée des autres composés d'un mélange, considérés comme impuretés. L'extraction et la purification sont apparentées ;
synthétiser, c'est-à-dire mettre en œuvre un ensemble de réactions chimiques en vue d'obtenir un ou plusieurs produits ;
analyser, c'est-à-dire reconnaître et caractériser des substances connues ou inconnues.
Réaction chimique |
Une réaction chimique constitue la transformation d’une ou de plusieurs espèces chimiques en d'autres espèces chimiques. Elle implique l'apparition ou la disparition d'au moins une liaison chimique ou un échange d'électron. La réaction qui possède des caractéristiques thermiques nécessite ou fait apparaître différentes formes d’énergie en rapport avec l'énergie de liaison chimique.
Solution et émulsion |
Une solution se présente par un mélange homogène formé par un solvant en proportion majoritaire et d'un ou plusieurs solutés dans une phase homogène. Les réactions chimiques ont souvent lieu en solution. La solubilité représente la capacité d'un corps à entrer en solution dans un milieu donné. Par exemple, un sel cristallin comme le chlorure de sodium NaCl ou sel de cuisine possède une limite de solubilité dans l'eau : 357 g·kg-1 d'eau à 0 °C et 391 g·kg-1 à 100 °C. Cela signifie qu'à partir de cette teneur limite, le sel précipite ou se dépose sous forme solide. Il y a alors de séparation de phase.
La miscibilité constitue la capacité d'un corps à se mélanger avec un autre en formant une seule phase. Le gaz ammoniac NH3 se mélange facilement à température ambiante avec l'eau liquide formant l'ammoniaque, 1 kg d'eau froide saturée d'ammoniac peut contenir 899 g de NH3. Les gaz principaux de l'air, dioxygène et diazote, sont aussi solubles en certaines proportions dans l'eau liquide. 100 g d'eau liquide à 0 °C peut contenir au maximum 4,89 cm3 du premier en solution et 2,3 cm3 du second.
Une émulsion se décrit comme une dispersion d'une phase liquide à l'état de gouttelettes microscopiques ou submicroscopiques, dans une autre phase liquide non miscible. Une suspension constitue une dispersion d'une phase solide finement divisée au sein d'une autre phase liquide englobante. La stabilité d'une suspension ou d'une émulsion nécessite que les fines gouttelettes ou les grains en suspension soient stabilisés par des molécules amphiphiles qui se placent à l'interphase. Ainsi, aucune coalescence des gouttelettes ni d'agglomérations de particules solides ne persiste. Comme le précise le chimiste et gastronome moléculaire, Hervé This, l'immense majorité des systèmes culinaires ne constituent pas des émulsions, mais des dispersions colloïdales plus ou moins complexes[26].
L'art, à l'origine souvent empirique, de fabriquer des dispersions colloïdales a fourni des applications en pharmaceutique comme en cuisine, par exemple pour la préparation de chocolats et glaces, de sauces ou de mayonnaises.
Oxydoréduction et électrochimie |

Schéma simplifié d'une pile Volta, l'une des applications communes de l'électrochimie.
Une réaction d'oxydoréduction constitue un échange d’électrons entre différentes espèces chimiques. L'espèce qui capte les électrons est appelée « oxydant » ; celle qui les cède, « réducteur ».
Acide et base |

Papier indicateur de pH, pour évaluer grossièrement l'acidité d'une solution aqueuse.
Les réactions acides-bases en solution sont basées aussi sur des couples d'espèces chimiques. L'acidité et la basicité peuvent être calculées ou mesurées par la concentration des espèces chimiques en solution, qui prend une forme acide ou basique. Svante Arrhenius a mis en évidence dans les solutions aqueuses l'échange de protons entre les composés chimiques, la concentration en ion hydronium (H3O+ ou Hexp+(aq)) indique l'acidité du milieu comme la concentration en ion hydroxyde (OH-) la basicité. Une extension de la modalité de classification à d'autres milieux solvants a été conduite par le chimiste américain Gilbert Newton Lewis.
Synthèse chimique |
Une synthèse chimique se décrit comme un enchaînement de réactions chimiques mis en œuvre de façon volontaire par un chimiste pour l'obtention d'un ou de plusieurs produits, parfois avec isolation de composés intermédiaires.
Réaliser la synthèse d’un composé chimique, permet d'obtenir ce composé à partir d’autres composés chimiques grâce à des réactions chimiques. La planification de l'enchaînement des réactions afin de maximiser l'efficacité de la synthèse (nombre d'étapes, rendement, simplicité des réactions, considérations toxicologiques et environnementales) se nomme la stratégie de synthèse.

La synthèse de Fischer de l'indole.
La chimie organique représente principalement une chimie de synthèse, on parle alors de synthèse organique. Des aspects synthétiques importants se retrouvent également en chimie inorganique et en chimie des polymères.
Chimie des polymères |

Structure moléculaire du Kevlar, marque déposée de fibres aramides, formant des couches solides et résistantes au choc et à la pénétration, matière de choix pour les casques ou gilets pare-balles.
Les polymères constituent de grandes molécules ou macromolécules dont un grand nombre des plus communs est formé par la réaction en chaîne de petites molécules appelées monomères. Ces polymères de synthèse industrielle, dont la structure est fondée sur la répétition d'un motif organique, parfois linéaire, ramifié ou greffé, en réseau ou interpénétré, etc. Concernant les polymères formés par polyaddition de monomères organiques dont le site réactif constitue justement la double liaison carbone-carbone, le grand squelette plus ou moins souple formé d'atomes de carbone qui est décrit par ses configurations et longueur(s) de chaîne moyenne(s) influence les propriétés observées. Citons parmi ces polymères organiques, les polyéthylènes, les polypropylènes, les polystyrènes, les polyisoprènes, les polybutadiènes, les PVC et les polyacryliques. D'autres sortes de réactions de polymérisations existent, comme les polycondensations à l'origine des polyesters, polyamides, polycarbonates, polyuréthanes. Sans compter aussi des polymères à motifs minéraux, comme les silicones ou les polysulfures.
L'existence des macromolécules ou polymères naturels avait été pressentie par le pionnier Hermann Staudinger en 1910. Elles peuvent être à motif de glucose ou sucre chimique comme la cellulose ou l'amidon, à motif d'acides aminés comme les protéines et ADN. La chimie macromoléculaire née dans les années 1930 a constitué un domaine continûment innovateur, même au cours des dernières décennies.
Lois chimiques |

Antoine Lavoisier et sa femme, principale collaboratrice en chimie.
La chimie, science expérimentale et descriptive, prenant un essor remarquable à l'époque industrielle tout en acceptant la modélisation physique et le langage mathématique là où ils semblaient pertinents, a découvert ou ouvert la voie à nombreuses lois physico-chimiques.
Lois de structure
Règles de l'octet, de Hund, de Klechkowski et de Pauli qui avec d'autres règles sur la stabilité du nuage électronique permettent de prévoir la configuration électronique des atomes.
Théorie VSEPR ou Valence Shell Electronic Pairs Repulsion qui permet de prévoir la géométrie des molécules.
Lois de cinétique et de thermodynamique
Loi d'Arrhenius qui relie la constante de vitesse d'une réaction à l'énergie d'activation et à la température.
Loi de Hess qui permet de déterminer les enthalpies de réaction à partir des enthalpies standards de formation.
Loi de Henry et loi de Raoult qui permettent de déterminer la solubilité d'un gaz dans un liquide ou la pression de vapeur d'une solution idéale.
Loi de Guldberg et Waage qui permet de définir l'équilibre thermodynamique d'un système réactionnel.
Loi expérimentale de van 't Hoff qui permet de prévoir le sens d'un déplacement d'équilibre en fonction de la température.
Lois de conservation
Principe de conservation de la masse illustré par la célèbre phrase d'Antoine Lavoisier : « Rien ne se perd, rien ne se crée, tout se transforme. »
Loi de Soddy qui illustre la conservation du nombre de charges.
Lois de spectroscopie
Loi de Beer-Lambert qui relie l'absorbance d'un élément en solution à sa concentration.
Loi de Kasha qui décrit dans le modèle quantique la phosphorescence et la fluorescence.
Lois d'électrochimie
Loi de Nernst qui relie la tension d'équilibre d'une électrode au potentiel standard du couple redox mis en jeu.
Loi de Kohlrausch qui permet de mesurer des conductivités de solution.
Loi limitée de Debye-Hückel qui permet de déterminer des coefficients d'activité.
Lois de chimie organique
Règle de Markovnikov et de Zaïtsev qui permettent de prévoir la régiosélectivité d'une réaction.
Lois de l'équilibre chimique
Principe de Le Châtelier stipulant qu'un équilibre chimique se déplace dans le sens opposé à une perturbation de cet équilibre.
Enseignement |

Une salle de chimie : les paillasses équipées facilitent manipulations et expériences, plus fonctionnelles que des tables de cours.
Le laboratoire, souvent le meilleur endroit de formation à cette science expérimentale, nécessite des moyens coûteux, une lourde surveillance et une organisation souvent disproportionnée pour un usage souvent trivial.
France |
La chimie est introduite dès le Cycle 3 primaire (CE2, CM1, CM2) dans le cadre de l'enseignement des Sciences expérimentales et Technologies (B.O. 2011[27]). Ces premières notions (par exemple unités de mesure, mélanges, solutions, les différents états de la matière et les changements d'états...) sont introduites dans le cadre d'activités essentiellement expérimentales et de résolution de problèmes concrets, issus pour la plupart de la vie quotidienne, en lien avec les autres matières de la formation (Sciences de la Vie et de la Terre, Physique, Technologie, Informatique...). Ici le but n'est pas forcément l'accumulation de connaissances, mais plutôt l'initiation à la résolution de problèmes et l'éveil de la curiosité de l'élève, celui-ci étant en général confronté à une situation concrète, en autonomie, à partir de supports variés (manuels, expériences menées en classe ou à la maison, documents audio-vidéo, logiciels, animations interactives...). Le choix des expériences réalisées est laissé à la discrétion de l'enseignant, ainsi que le contenu exact des séquences.
La chimie est ensuite enseignée au collège en même temps que la physique dès la cinquième à raison d'une heure et demie en moyenne, par semaine, et indépendamment des autres matières scientifiques et techniques (Sciences de la Vie et de la Terre et Technologie).
Ensuite, au lycée, les élèves commencent par trois heures et demie de physique-chimie par semaine, dont une heure et demie de travaux pratiques en seconde. La poursuite de l'enseignement de la chimie dépend du choix d'orientation des élèves : jusqu'en première, uniquement pour les élèves des filières littéraires et économico-sociales ; et jusqu'en terminale pour les élèves des filières scientifiques, STL, STAV et ST2S.
Enfin, la chimie peut être étudiée après le baccalauréat en CPGE, en UFR de chimie ou de sciences (université), en IUT de chimie (université) ou en école de chimie. De nombreuses écoles d'ingénieurs dans le domaine de la chimie sont regroupées au sein de la fédération Gay-Lussac.
Québec |
En 2009 au Québec, les cours de chimie et de physique constituent des options que peut prendre l'élève de cinquième secondaire. Cela pousse plus loin le cours de « sciences et technologie » qu'il a été obligé de suivre durant les dernières années de son secondaire. En temps normal, pour être admis dans les cours de chimie et de physique de cinquième secondaire, les élèves doivent avoir suivi avec succès le cours de « sciences et technologie de l'environnement » en quatrième secondaire. Les options de chimie et de physique servent comme critère d'admission dans plusieurs programmes du cégep comme les cours de sciences pures et appliquées, de sciences de la nature et de sciences de la santé.
Suisse |
En 2009 en Suisse, la chimie est enseignée au gymnase dès la dixième année de scolarité. Les universités de Bâle, de Genève, de Berne, de Fribourg et de Zurich forment des chimistes et les écoles polytechniques, comme l'École polytechnique fédérale de Lausanne, des ingénieurs chimistes et des chimistes.
Industrie |

Schéma d'une cellule d'électrolyse en bain minéral fondu pour la synthèse de l'aluminium.

Médicaments conditionnés en pastilles ou pilules.

Pigment bleu 28 en poudre. Les colorants, un des secteurs industriels à haut profit de la fin du XIXe siècle.
L'industrie chimique se développe continûment à la fin du Siècle des Lumières. Si la métallurgie n'est pas oubliée, le progrès reste partout observable. Le fer-blanc devient un produit commun entre 1770 et 1780. Après 1780, en plus des métaux, elle mêle des fabrications millénaires à des innovations récentes. Ces fabrications constituent les acides et la « soude », l'ammoniac, le dichlore et les chlorures décolorants, le phosphore et ses dérivés, les savons et acides gras, le dihydrogène, l'« éther », l'éthylène, l'alcool de vin, l'acide acétique. À tout cela s'ajoute surtout de nombreux sels et une multitude de dérivés organiques et minéraux préparés ou recueillis dans un cadre traditionnel.
Elle prend un essor prodigieux au XIXe siècle et participe pleinement aux fortes mutations de la révolution industrielle[28]. Le gaz d'éclairage, produit de la distillation de la houille ou charbon gras, lance l'immense essor de la carbochimie. La découverte de métaux, leurs préparations au laboratoire, puis au stade industriel, comme l'aluminium et les métaux alcalins et alcalino-terreux, témoignent de la vigueur de la science très proche de l'industrie.
En 1981, usines et laboratoires fabriquent déjà dans le monde plus de 100 000 composés, mettant en œuvre des centaines de réactions chimiques types. Chercheurs et institutions savantes décrivent et référencent les procédés, réactions et molécules[29]. En 2011 103 000 substances différentes sont commercialisées au niveau de la Communauté économique européenne, dont 10 000 en quantités supérieures à 10 t/an et 20 000 en quantités comprises entre 1 et 10 t/an. L'ère industrielle a vu la production mondiale de substances chimiques passer d'un million de tonnes en 1930 à 400 millions de tonnes en 2009[30].
L'industrie chimique représente une part importante de l'activité économique des grands pays industriels au XXe siècle. Dans les années 1970, elle intéresse au sens large la moitié du capital industriel mondial. La variété des matériels et des technologies qu'elle utilise reste incroyablement vaste, comme l'indique une visite au pas de course des exposants pendant les jours de l'Achema à Francfort.
Parmi les activités chimiques, citons les secteurs suivants :
métallurgie :
- métallurgie qui transforme les minerais en métaux et en alliages, fonderies métalliques ;
- métallurgie de spécialités, silicium, matériaux semi-conducteurs ;
- aimants, conducteurs et matériaux pour turbines ;
électrochimie :
- piles, batteries, électrochimie appliquée ;
traitement de surface, galvanoplastie ;
matériaux :
- plâtre, chaux, ciments et mortiers ;
- matériaux réfractaires et technologie des fours ;
verres, argiles et céramiques, faïences et porcelaine ;- pigments et charges minérales, émaillerie ;
- industrie du bois papier et cellulose, couchage du papier ;
raffinage du sucre ;
chimie organique :
- acides gras, corps gras et savons ;
- chimie des substances naturelles, chimie médicale et pharmaceutique ;
- parfums, huiles essentielles, produits cosmétiques ;
- engrais, chimie agricole, explosifs ;
- ligneux, bois, charbons et pétroles, combustibles, mais aussi matières premières pour la carbochimie et la pétrochimie. Ci-dessous, souvent présente en tout ou partie :
- lubrifiants, graisses, produits à propriétés tribologiques ;
colorants, intermédiaires de réactions photochimiques ;
macromolécules, polymères, plastiques (matériaux thermoplastiques et thermodurcissables) ;
peinture, vernis :
- traitement de fibres textiles, apprêt et teinture ;
détergents, agents de surface, produits décapants ou de nettoiement, adoucissants des eaux ;- produits phytosanitaires, insecticides, herbicides ;
médicaments, antibiotiques.
Cette industrie peut se scinder en deux grands types :
- la synthèse de produits organiques à partir du pétrole par exemple, celle de l'acide acétique, du méthanol, d'oléfines comme l'éthylène, le propylène, etc. ;
- la chimie minérale avec les gaz industriels, les acides et les bases, les sels, etc.
L'ampleur de la production chimique caractérise la « chimie lourde » ou bulk chemistry avec ses procédés automatisés et ses énormes masses traitées ou extraites. La chimie fine se limite à des quantités restreintes de composés, souvent à haute valeur ajoutée pour la pharmacie, la parfumerie et la cosmétique ainsi que dans de nombreux domaines ciblés de haute technologie ou nanomatériaux.
La chimie a permis d'accéder à de nouveaux matériaux, métaux, plastiques, ou céramiques qui trouvent des applications importantes dans notre vie la plus quotidienne. Les progrès chimiques ont permis de synthétiser directement certains médicaments au lieu de les extraire des plantes.
Recherche |
Institutions ou associations nationales et sociétés professionnelles |
- Académie royale des sciences de Suède
- Agence européenne des produits chimiques
- American Chemical Society
- American Society for Neurochemistry
- Chemical Institute of Canada
- Royal Australian Chemical Institute
- Royal Netherlands Chemical Society
- Royal Society of Chemistry
Société chimique de France (1983-2009 : Société française de chimie)- Société suisse de Chimie
- Society of Chemical Industry
Union internationale de chimie pure et appliquée (IUPAC en anglais)- World Association of Theoretical and Computational Chemists
- Liste de sociétés chimiques
Prix |
Médaille Davy, décernée par la Royal Society depuis 1877
Prix Nobel de chimie, décerné par l'Académie royale des sciences de Suède depuis 1901
Prix Hudson, décerné par l'American Chemical Society depuis 1946
Médaille Leverhulme, décernée par la Royal Society depuis 1960
Prix de science macromoléculaire et de génie, décerné par l'Institut de chimie du Canada depuis 1971
Prix Wolf de chimie, décerné par la fondation Wolf en Israël depuis 1978
Médaille Lavoisier, décernée par la Société chimique de France
Applications et toxicologie |
La chimie œuvre partout dans la nature, les corps vivants, les choses de la vie quotidienne sans que l'observateur attentif et disposant de puissants multiplicateurs sensoriels puisse correctement l'imaginer ou le modéliser. Un chimiste représente dès l'origine un expert des bilans matière et énergie et il sait intuitivement qu'il devrait prendre en compte tous les milieux et les acteurs microbiologiques, végétaux, animaux et humains. Lui en laisse-t-on les moyens ?
De la chimie en bien et en mal |

Eaux du Rio Tinto acides et colorées par des rejets miniers.
Citons quelques applications. D'abord la mesure. L'analyse précise de solutions diluées dans un solvant, contenant des molécules solubles plus ou moins complexes, constitue le fruit de longues mises au point analytiques, aujourd'hui très vite réalisées et banales, comme en chimie des solutions aqueuses. Pensons aux analyses banalisées de l'eau du robinet reconnue potable ou des eaux minérales du commerce. Les (bio)chimistes spécialistes des eaux présente un rôle de surveillance des eaux naturelles et de leurs qualités ou toxicités éventuelles. Le recours à la désinfection chimique de l'eau du robinet avant consommation pourrait être modéré en réalisant des progrès substantiels[réf. nécessaire]. En fin d'usage, la maîtrise des procédés chimiques et biologiques permet le traitement des eaux usées dans les stations d'épuration.
Ensuite l'usage. La chimie la plus simple peut commencer avec la fabrication et l'usage du sel, nécessaire à l'alimentation et capital pour les vieux procédés de conservation des aliments. Aujourd'hui, les produits de l'industrie agroalimentaire ont recours à une gamme plus variée de conservateurs, agents de conservation ou agents nutritifs, additifs alimentaires comme les colorants, les arômes artificiels et les édulcorants.

Résidus et déchets de consommation flottants.
Des emballages alimentaires à la préservation des récoltes, une connaissance raisonnée des matériaux et des aliments permet d'éviter le gaspillage et les déperditions tout en préservant les qualités et propriétés nutritionnelles des futurs aliments. Suivant l'usage, certains emballages sont biodégradables et, à l'aide du tri sélectif après utilisation, ils sont transformés et revalorisés grâce à des procédés chimiques de recyclage ou une combustion ultime qui permet de ne pas gaspiller l'énergie qu'ils recèlent.
L'agriculture a subi une mutation technologique[31] et elle est devenue fortement dépendante d'intrants chimiques. Certainement que l'utilisation à grande échelle d'engrais chimiques, l'usage irraisonné de pesticides et d'insecticides dans des monocultures de plus en plus sensibles ou fragiles peut constituer une impasse désastreuse à long terme pour les sols. L'écologie des terres et la santé des animaux et des hommes qui y vivent ou vivront, ainsi que les tenants de l'agriculture biologique le postulent dans l'immédiat. Si l'on donne à un homme un couteau, il peut découper finement un jambon de façon à le partager avec ses amis, ou encore égorger sauvagement ses voisins perçus en ennemis. L'utilisation des technologies chimiques recèle des bienfaits potentiels ou de terribles dangers selon les usages ou les objectifs. Elle échappe autant aux chimistes qu'à l'honnête homme de la rue. Par exemple, un chimiste organicien considère comme une absurdité de brûler de l'essence dans un moteur à combustion. Pour lui cette matière de choix permet de réaliser d'autres molécules chimiques à usage varié qui, alors seulement au terme de leur usage, pourraient être décomposées et brûlées. Le gain sur une courte échelle de temps d'une famille de produits chimiques, parfois peu sophistiqués et à utilisation massive, permet d'obtenir des profits évidents. Ainsi s'obtiennent des récoltes plus abondantes en enrichissant les sols pauvres et en éliminant les insectes nuisibles, les champignons parasites, les mauvaises herbes et la faune associée. Mais qu'advient-il à longue échéance ? Après avoir provoqué l'éradication de multiples espèces d'oiseaux, l'affaiblissement des hyménoptères butineurs, la prise de conscience générale des dommages causés à l'environnement devient vitale. Les sociétés agrochimiques produisent alors de nouveaux produits plus efficaces ou plus ciblés qui peuvent soit respecter mieux l'environnement soit entraîner d'autres catastrophes parfois plus pernicieuses alors que la course au profit immédiat implique de minorer toute information alarmiste.
La chimie explique sommairement la formation du bois et des textiles naturels ou permet la synthèse de larges gammes de matières et de types de matériaux. Parmi eux se trouvent fibres synthétiques (comme le nylon, le Lycra et la fibre PET pour fabriquer des polaires), mobilier en matière plastique, etc.
Dans le domaine de la construction, la chimie a beaucoup évolué en contribuant aussi à la fabrication de matériaux, d'isolants performants, de peintures ou de vernis, de mastics, de produits d'entretien et d'ameublement. Les désagréments causés par les produits des premières générations ont été très lentement corrigés, puis les générations suivantes apportent d'autres inconvénients.

L'explosion spectaculaire de la raffinerie de Catano. Les accidents des usines chimiques peuvent causer de graves conséquences sur l'environnement.
Un nombre important d'applications chimiques ont trouvé ou trouvent encore des débouchés et usages commerciaux profitables, alors qu'une connaissance approfondie et précise des méfaits de leurs emplois ou mésusages fait défaut tant aux utilisateurs qu'au public. La chimie toxicologique constitue une parente pauvre. Alors que les grands groupes pétrochimiques se sont vantés dans les années 1970 d'apporter une sécurité écologique, les 200 000 molécules que leurs activités ont permis de confectionner ne sont véritablement connues du toxicologue qu'à 1 %. Le progrès, plus visible depuis longtemps, représente un bouleversement, un gain éhonté pour certains, une menace vitale pour les moins favorisés. Cependant, comment essayer de maîtriser et de juguler le danger sans faire confiance à la collégialité de différents chimistes, renforcées au besoin d'équipes expertes de mathématiciens, physiciens, de biologistes, etc., et à leurs éthiques de vérité scientifique ?[réf. nécessaire]
Santé et environnement |
La découverte et la synthèse de médicaments qui contribuent à l'augmentation de l'espérance de vie enregistrée depuis la fin de la révolution industrielle dans les pays développés sont aussi à l'actif des techniques de la chimie. Mais la médicalisation massive d'une population entraîne d'irréductibles problèmes de pollutions, car les molécules ou leurs produits sommaires de dégradations se retrouvent dans les eaux usées.
Dans le domaine « Santé-environnement », la chimie constitue une source de problème par certains polluants qu'elle crée ou contribue à diffuser dans l'environnement, en particulier les produits chimiques toxiques ou écotoxiques dont les CMR « cancérogènes, mutagènes et reprotoxiques ». Certains produits tels que médicaments, pesticides, catalyseurs ou leurs résidus perdus dans l'environnement ou présents dans l'alimentation peuvent ensuite poser des problèmes d'environnement ou de santé, en particulier avec les perturbateurs endocriniens.
Les substances chimiques incarneraient « au premier rang des accusés » la chute de la qualité des spermatozoïdes (réduite de 50 % depuis 1950) et des maladies liées à l'appareil génital à travers les perturbateurs endocriniens. Le 25 novembre 2008, le gouvernement français (à travers l'IReSP, structure de recherche créée par l'INSERM et 20 partenaires) et l'Afsset ont organisé un colloque sur le thème : « Environnement chimique, reproduction et développement de l'enfant. » Les principales matières incriminées sont les phtalates et le bisphénol A[32], deux additifs présents dans les matières plastiques.
Risques et réglementation |
Au niveau international, la convention de Rotterdam, administrée par l'ONU (PNUD, FAO) a été adoptée par 165 pays en 1998 pour mieux assurer la santé des personnes et de l’environnement contre des dommages éventuels induits par le commerce de produits chimiques.
De nombreuses législations concernent les produits chimiques et leurs résidus, qui varient selon les pays. Des bases de données et guides sur le risque chimique existent, donc en France[33].
La chimie fantasmée |
Le chimiste apparaît souvent en personnage caricatural de la littérature, de la bande dessinée et surtout du cinéma. Ces savants échevelés ou docteurs désopilants, à la fois et confusément biologistes, chimistes et physiciens, constituent des êtres sourds au monde vrai ou perdus hors du laboratoire et de l'étude ; à moins de remonter le temps, d'aller dans un autre monde ou sur la Lune, à l'image du professeur Tournesol. Ils interviennent surtout de façon intermittente, par leur action, tantôt décisive tantôt inquiétante, car elle oriente la fiction.
Dans un registre comique, alliant de façon classique la chimie et l'amour, citons le film Docteur Jerry et Mister Love avec Jerry Lewis (1963), et Jean Lefebvre jouant le rôle d'Eugène Ballanchon dans Le Fou du labo 4 de Jacques Besnard (1967).
Littérature |
La représentation littéraire du chimiste dans de nombreuses œuvres constitue une grande différente de la réalité. Il est considéré comme un savant venu d'ailleurs qui vit hors du temps. Le chimiste se présente alors en demi-sorcier, image issue de l'ancien alchimiste, qui joue avec des forces obscures qu'il ne maîtrise pas afin de rivaliser avec la nature. La chimie est souvent associée avec l'occulte alors qu'elle représente une science reconnue.
Toutefois, il faut soustraire à ce tableau Le Système périodique de Primo Levi. Cet ouvrage littéraire italien sur le thème de la chimie comporte vingt et un chapitres qui, chacun séparément, illustrent un élément du tableau de Mendeleïev. Ces parties descriptives qui ont été conçues avec le support spatial du tableau périodique et l'art du chimiste relatent au besoin la vie professionnelle de l'écrivain. Par ailleurs chimiste spécialiste de peinture et directeur du laboratoire d'une petite unité de production à Turin, des anecdotes ou rencontres autobiographiques ou de courtes nouvelles complémentaires inventées, judicieusement choisies.
Notes et références |
d'après l'American Chemical Society
Le rayon de l'électron est de 2,8 fm (voir Lange's Handbook of Chemistry). Un fermi est aussi la taille du noyau où la force électromagnétique devient négligeable par rapport à l'interaction forte.
(en) Theodore L. Brown, Chemistry: The Central Science, Prentice Hall, 1977(ISBN 978-0-13-128769-3).
Christiane Desroches-Noblecourt, Le fabuleux héritage de l'Égypte, Paris, Pocket, 2006, 319 p. (ISBN 9-7827-5330-0095), p. 172
« Étymologie d’alchimie », sur centre national de ressources textuelles et lexicales (consulté le 20 octobre 2014)
Définitions lexicographiques et étymologiques de « Alchimie » du Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
J.C. Risler, La civilisation arabe, Paris, Payot, 1955, p. 111
Risler, op. cit.
Marcellin Berthelot et Ch -Em Ruelle, Collection des anciens Alchimistes grecs, 1988(OCLC 3927892)
Bernard Joly, Rationalité de l'alchimie au XVIIe siècle, Paris, Vrin, coll. « Mathesis », 2002, 408 p. (ISBN 9782711610556, lire en ligne)
Thomas Samuel Kuhn, La Structure des révolutions scientifiques, 1962
En 1814, André-Marie Ampère, de façon indépendante, découvre la même idée sur les gaz, mais il brouille pour des décennies la nomenclature en appelant les particules atomes. Continuateur de la chimie pneumatique dans la lignée d'un Lavoisier, Gay-Lussac prouve par ses nombreuses expériences la fécondité de cette approche volumique.
Claude Lécaille, L'atome : chimère ou réalité ? : Débats et combats dans la chimie du XIXe siècle, Paris, Vuibert, Adapt-SNES, coll. « Inflexions », 2009
Stanislao Cannizzaro, fougueux chimiste italien d'origine sicilienne ressuscitant l'enthousiasme du congrès longtemps indécis, rétablit la théorie d'Avogadro et réclame un système de masse atomique.
Loschmidt estime par calcul de théorie cinétique en 1865 leur taille à un nanomètre.
Alain Dumon et Robert Luft, Naissance de la chimie structurale, Les Ulis, EDP Sciences, coll. « Science et Histoire », 2008
On le ressent fortement si l'attention est portée sur des thèmes précis. Ainsi, L. Leclercq, « La chimie française vers les mécanismes réactionnels (1800-1930) », L'Actualité chimique, no 329, avril 2009, p. 42-50.
Dans la pratique des exposés scientifiques, l'élément désigne une partie commune aux corps simples et à tous les corps qu'il peut former. L'élément oxygène O évoque O2, O3, les composés oxygénés, etc.
Définitions lexicographiques et étymologiques de « atome » du Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
Molécules provient de moles, désignant la masse ou le nombre de petits éléments de matière pour les atomistes.
Liaison provient du latin, ligatio, façon de s'habiller. Le rôle de l'électron dans cet habillage moléculaire a été révélé par J.J. Thomson en 1897.
Au niveau du laboratoire, le corps le plus pur possible est manipulable et facilement observable avec intérêt. Il permet d'étudier les propriétés physiques concrètes impossible de reporter à la seule molécule.
Citons parmi les corps simples, le dioxygène O2, l'ozone O3, le sodium Na, le soufre S8. Les corps simples sont différents des éléments. Dmitri Mendeleïev, qui impose cette distinction en 1871, affirme « le mot élément appelle l'idée d'atome ». Remarquons aussi que le corps composé n'est pas un mélange.
Durupthy, Manuel de chimie de Terminale S, Hachette éducation, 2006, 368 p., p. 10-11
« Dossier de l'ENS sur la chimie expérimentale. », sur ENS (consulté le 20 octobre 2014)
Le beurre, la crème, le chocolat, le fromage, le foie gras, l'huile sont des milieux polyphasiques. C'est-à-dire se comportent plusieurs phases dont au moins deux phases liquides non miscibles, l'une étant finement dispersée dans l'autre phase liquide majoritaire et continue. Le lait n'est qu'en ce sens restreint — toujours en usage dans l'industrie alimentaire — assimilé à une émulsion nutritive d'une phase huile dans l'eau.
http://media.eduscol.education.fr/file/Progressions_pedagogiques/77/1/Progression-pedagogique_Cycle3_Sciences_experimentales_et_technologie_203771.pdf
Le progrès est d'ailleurs beaucoup moins visible et apprécié dans la vie réelle, car il révolutionne les modes de vie et bouleverse les vies précaires
Catalogues, encyclopédies, ouvrage de référence type Beilstein apparaissent.
Laura Maxim, La chimie durable. Au-delà des promesses..., CNRS Éditions, 2011(ISBN 978-2-271-07277-1), p. 7
Depuis le début du XIXe siècle, l'agriculture a subi une mutation technologique grâce à la chimie : c.f. historique de la chimie agricole dans V. Vaillant, Petite chimie de l'agriculteur, Paris, coll. « Institut industriel du Nord »()
« La chimie menace la reproduction humaine », Le Monde, 25 novembre 2008, p. 1 et 4
« 121 questions/réponses sur la prévention des risques chimiques » [PDF], DIRECCTE des Pays de la Loire, octobre 2011(consulté le 20 octobre 2014)
Voir aussi |
.mw-parser-output .autres-projets ul{margin:0;padding:0}.mw-parser-output .autres-projets li{list-style-type:none;list-style-image:none;margin:0.2em 0;text-indent:0;padding-left:24px;min-height:20px;text-align:left}.mw-parser-output .autres-projets .titre{text-align:center;margin:0.2em 0}.mw-parser-output .autres-projets li a{font-style:italic}
Articles connexes |
- Nomenclature de l'UICPA
- Nomenclature des alcanes
- Représentation des molécules
- Base de données chimiques
- Liste de biomolécules
- Liste de composés inorganiques
- Liste de composés organiques
- Liste de minéraux
- Année internationale de la chimie
- Adsorption
- alliage
- allotropie
- ampholyte
- catalyseur
- céramique
- combustion
- corrosion
- couche de valence
- Nombre d'oxydation
- équation chimique
- électronégativité
- hydrolyse
- Laboratoire
- ligand
- matière dangereuse
- matière plastique
- métal
- orbitale moléculaire
- oxydoréduction en chimie organique
- réaction chimique
- sel
- solution tampon
- stœchiométrie
- substance chimique
- tableau périodique des éléments
- valence
- verre
- zwitterion
Bibliographie |
Ouvrage de découverte |
- Jacques Angenault, La chimie, dictionnaire encyclopédique : 2e éd., Dunod, 1995, 536 p. (ISBN 978-2-10-002497-1)
Peter William Atkins, Les molécules au quotidien, Paris, InterEdition, 1989, 196 p. (ISBN 978-2-7296-0296-3) (traduction par Gilberte Chambaud de l'ouvrage : (en) Peter W. Atkins, Molecules, New York, Scientific American Library, 1987
Ann Newmark en association avec le Science Museum de Londres, La Chimie, atomes et molécules en mouvement, Paris, Gallimard, coll. « passion des sciences », 1993, 64 p. (Traduction par Florence Delahaye de l'ouvrage :(en) Dorling Kindersley, Eyewitness Science Guide « Chemistry », Londres, Limited, 1993(ISBN 978-2-07-058129-0)
- Robert Luft, Dictionnaire des corps purs simples de la chimie, Nantes, Association Cultures et Techniques, 1997, 392 p. (ISBN 978-2-9510168-3-5)
- Hans Breuer, Atlas de la chimie, Munich, Le livre de poche, coll. « La Pochothèque », 2000, 476 p. (ISBN 978-2-253-13022-2)
Paul Rigny (directeur), De la matière au vivant, les systèmes moléculaires organisés, Paris, CNRS, coll. « Image de la recherche » (no 2), mars 1994, 268 p. (ISBN 978-2-271-05186-8) (ISSN 1162-2024)
- Mireille Defranceschi, L'eau dans tous ses états, Ellipses, 1996, 128 p. (ISBN 978-2-7298-9647-8)
John Emsley, Guide des produits chimiques à l'usage des particuliers, Odile Jacob, 1996, 33 p. (traduction de l'ouvrage : (en) W.H. Freeman, The consumer’s Good chemical Guide, Spektrum Akademischer Verlag, 1994(ISBN 978-2-7381-0384-0)
- (en) Ben Selinger, Chemistry in the Marketplace : 5e éd., Sydney, Harcourt Brace, 1998, 588 p. (ISBN 0 7295 3300 X)
- Ludovic Miseur, La chimie.net, cours et outils didactiques de chimie.
- Le Guide de la Chimie, Chimedit
Une science expérimentale |
- (en) Stuart W Bennett et Katherine 0'Neale, Progressive development of practical skills in chemistry : a guide to early-undergraduate experimental work, Cambridge, Royal Society of Chemistry, 1999, 171 p. (ISBN 978-0-854-04950-9, OCLC 758101518, présentation en ligne)
- Mireille Defranceschi, 144 manipulations de chimie générale et minérale, Paris, Ellipses, 1990, 192 p. (ISBN 978-2-729-89068-1, OCLC 77111116)
- Christophe Bureau et Mireille Defranceschi, Des teintures égyptiennes aux micro-ondes : 100 manipulations de chimie, Paris, Edition Marketing, 1993, 208 p. (ISBN 978-2-729-89335-4, OCLC 28819076)
- Stanislas Antonik, Le montage de chimie organique : CAPES et agrégation de physique et chimie, Paris, Ellipses, 1996, 191 p. (ISBN 978-2-729-89666-9, OCLC 34977463)
- Sylvie Haurat-Bentolila, Emmanuelle Lecorgne et Olivier Leduc, Chimie-Tout : expériences commentées - Classes préparatoires, universités, grandes écoles, Nantes, Cultures et techniques, coll. « Formation », 1995, 156 p. (ISBN 978-2-950-24446-8, OCLC 34520449)
- Mady Capon, Véronique Courilleau-Haverlant et Cécile Valette, Chimie des couleurs et des odeurs, Nantes, Cultures et Techniques, 1993, 255 p. (ISBN 978-2-950-24442-0, OCLC 28319467)
- Gilles André, Valérie Dartiailh, Frédérique Maksud, Sophie Pak-Blanès et Josette Fournier, Ecolochimie : chimie appliquée à l'environnement, Nantes (France, Cultures et techniques, coll. « Formation », 1994, 351 p. (ISBN 978-2-950-24444-4, OCLC 31422402)
- Dominique Deprost et al., Chimie dans la maison, Nantes, Cultures et techniques, coll. « Formation », 1996, 446 p. (ISBN 978-2-951-01682-8 et 978-2-951-01683-5, OCLC 37649221, notice BnF no FRBNF36160989)
- Marie Terrien et Josette Fournier, Chimie du petit déjeuner, Nantes (France, Cultures et techniques, coll. « Formation », 1998, 304 p. (ISBN 978-2-951-01685-9, notice BnF no FRBNF37036225)
Enseignement général, initiation ou formation à quelques spécialités de la chimie |
- Claude Duboc-Chabanon, Jean Talbot (dir.) et al., Chimie, Paris, A. Colin, coll. « U », 1987, 2 v.;319,256 p (ISBN 978-2-200-21057-1 et 978-2-200-21058-8)
- René Didier, Chimie générale, Paris, Technique et documentation, coll. « sciences physiques », 1984, 478 p. (ISBN 978-2-852-06163-7 et 978-2-852-06736-3, OCLC 25538307)
- C Moreau et J.-P. Payen, Chimie : maths sup MPSI et PTSI, Paris, Belin, coll. « Guides prépas », 1995, 319 p. (ISBN 978-2-701-11789-8, OCLC 34202562)
- Clyde R Metz et Romain Jacoud (trad. R. Jacoud), Chimie physique : cours et problèmes, Paris, McGraw-Hill, coll. « Série Schaum », 1982, 2 v., 234-204 p. (ISBN 978-2-704-21037-4 et 978-2-704-21038-1, OCLC 419757083, notice BnF no FRBNF34860917)
Peter William Atkins, Chimie Physique, Technique et documentation, Lavoisier et Vuibert, Paris, 1983, 1274 p. (Traduction par Gilberte Chambaud de Physical Chemistry, 2e éd., Oxford University Press, 1982. vol. 1, 616 p. (ISBN 978-2-85206-203-0) et vol. 2, 658 p. (ISBN 978-2-85206-204-7))- Odile Dessaux, Pierre Goudmand, Françoise Langrand, Thermodynamique statistique chimique, 2e éd., Dunod Bordas, 1982, 154 p. Préface de Guy Pannetier (ISBN 978-2-04-015518-6)
- Jean-Louis Rivail, Éléments de chimie quantique à l’usage des chimistes, Savoirs actuels, InterEditions/ éd. du CNRS, Paris, 1989, 426 p. (ISBN 978-2-7296-0193-5)
- Norman L. Allinger, M. Jerome Bingelow, Harmon C. Mc Allister, An introduction to General, Organic and Biological Chemistry, Wadsworth Publishing Company, Inc., Belmont, California, 1976, 582 p. avec index (ISBN 978-0-534-00375-3)
- Bruce H. Mahan, Chimie, InterEdition, Paris, 1977, 832 p. (Traduction de University Chemistry, 2e éd., Addison-Wesley Publishing Company, Massachusetts, 1969 (ISBN 978-2-7296-0065-5))
- J. D. Lee, Précis de chimie minérale, Dunod Université, Paris, 1986, 282 p. (Traduction en 1979 de la 2e éd. par V. Hérault de Concise Inorganic Chemistry, D. van Nostrand Company Ltd, Londres (ISBN 978-2-04-000916-8))
- C.S.G. Philipps, R.J.P. Williams, Chimie minérale, Dunod Université 1971. (Traduction par V. Hérault de Inorganic Chemistry, Oxford University Press, 1965 et 1966. t. 1 Généralités et non-métaux, 386 p. (ISBN 978-2-04-015529-2) et t. 2 Métaux, 700 p. (ISBN 978-2-04-015531-5))
- François Mathey, André Sevin, Introduction à la chimie moléculaire des éléments de transition, X école polytechnique, Ellipses, Paris, 1991, 224 p. (ISBN 978-2-7298-9127-5)
- Lesley Smart, Elaine Moore, Introduction à la chimie du solide, Masson, Paris, 1997. 358 p. (Traduction par Jean-Pierre Jolivet de Solid State Chemistry : An introduction, 2e éd., Chapman & Hall, Royaume-Uni, 1995 (ISBN 978-2-225-85621-1))
- Charles Deportes, Michel Duclot, Pierre Fabry, Jacques Fouletier, Abdelkader Hammou, Michel Kleitz, Elisabeth Siebert, Jean-Louis Souquet, Électrochimie des solides, Presses universitaires de Grenoble, 1994, 438 p. (ISBN 978-2-7061-0585-2)
- Robert Thornton Morisson and Robert Nelson Boyd, Organic Chemistry, 5e éd., Allyn and Bacon, Inc. Boston, 1434 p. plus index (ISBN 978-0-205-08452-4)
Pierre Laszlo, Logique de la synthèse organique, X école polytechnique, Ellipses, Paris, 1993, 208 p. (ISBN 978-2-7298-9326-2)
- Pierre Laszlo, Résonances de la synthèse organique, exemples et illustrations, X école polytechnique, Ellipses, Paris, 1993, 208 p. (ISBN 978-2-7298-9325-5)
- Jacques Fossey, Daniel Lefort, Janine Sorba, Les radicaux libres en chimie organique, Masson, 1993, 294 p. Préface de Guy Ourisson (ISBN 978-2-225-84202-3)
- Michel Madesclaire, Stéréoisomérie, généralités et incidences en chimie thérapeutique, Ellipses, Paris, 1987, 126 p. (ISBN 978-2-7298-8655-4)
- Ernest L. Eliel, Samuel H. Wilen, Lewis N. Mander, Stéréochimie des composés organiques, Lavoisier Technique & Documentation, Paris, 1996, 1312 p. Version française de Stereochemistry of Organic Compounds, John Wiley and Sons, Inc., 1994, préparée par Robert Panico et Jean-Claude Richer (ISBN 978-2-7430-0160-5)
Jean-Marie Lehn, La chimie supramoléculaire, concepts et perspectives, De Boeck Université, 1997, 274 p. (ISBN 978-2-8041-2504-2) (traduction par André Pousse de J.-M. Lehn, Supramolecular Chemistry, VCH Verlaggeselleschaft, Weinheim, FRG, 1995)- Serge David, Chimie moléculaire et supramoléculaire des sucres, Introduction chimique aux glycosciences, Savoirs actuels, InterEditions/ éd. du CNRS, Paris, 1995, 300 p. (ISBN 978-2-7296-0528-5)
- Kurt Faber, Biotransformations in organic chemistry, a textbook, 3e éd., Springer, Berlin, 1997, 402 p. (ISBN 978-3-540-61688-7)
Gaston Charlot, Chimie analytique quantitative, Masson, Paris, 1984, 2 tomes de 326 et 280 p. (ISBN 978-2-225-39259-7)
- Philippe Chappuis (coordonnateur), Techniques d’analyse des oligoéléments chez l’homme (Al, Cr, Co, Cu, Mn, Hg, Ni, Pb, Se, Zn), Techniques & documentation, Lavoisier, 1995, 158 p. (ISBN 978-2-7430-0019-6)
- Francis Rouessac, Annick Rouessac, Analyse chimique, méthodes et techniques instrumentales modernes, 2e éd., Masson, 1994, préface de Guy Ourisson, 306 p. (ISBN 978-2-225-84523-9)
- Douglas A. Skoog, Donald M. West, F. James Holler, Chimie analytique, De Boeck Université, Bruxelles, 1997, 870 p. plus glossaire 20 p. + Appendice 58 p. plus Index 24 p. (Traduction collective de la 7e éd. américaine de Fundamentals of analytical chemistry, Saunders College Publishing, 1996 (ISBN 978-2-8041-2114-3))
- J. Michael Hollas, Spectroscopie, Cours et exercices, Dunod, Paris, 1998. 386 p. (Traduction par Daniel Simon de Modern Spectroscopy, 3e éd., John Wiley & Sons, 1996 (ISBN 978-2-10-003945-6))
- Harald Günther, La spectroscopie de RMN, principe de base, concept et applications de la spectroscopie de résonance magnétique nucléaire du proton et du carbone 13 en chimie, Science de l’ingénieur, Masson, 1993, 558 p. (Traduction de Jean et Jean-Jacques Suffert de l'ouvrage allemand NMR-Spectrokopie 3/E, Georg Thieme Verlag, 1992 (ISBN 978-2-225-84029-6))
- Robert Rosset, Marcel Caude, Alain Jardy, Manuel pratique de chromatographie en phase liquide, 2e éd. revue, Masson, Paris, 1995, 374 p. (ISBN 978-2-225-85126-1)
- Jean Poré, Émulsions, microémulsions, émulsions multiples, éd. Techniques des Industries des Corps Gras, Neuilly, 1992, 270 p. (ISBN 978-2-9507241-0-6)
- Georges Champetier (dir.), Chimie macromoléculaire, Hermann, éditeurs des sciences et des arts, Paris, réédition des deux tomes en 1988 t. 1, 808 p. (ISBN 978-2-7056-5553-2) et t. 2, 890 p. (ISBN 978-2-7056-5707-9)
- Groupe français d’études et d’applications des polymères, Initiation à la chimie et à la physico-chimie macromoléculaires, 9 vol. rédigés sous l’égide de la commission d’enseignement, Strasbourg, 1970 à 1993 :
- Physico-chimie, 213 p. ;
- Propriétés physiques des polymères, mis en œuvre, 383 p. ;
- Chimie des polymères, 1981, 396 + 72 p. ;
- Quelques grands polymères industriels, synthèse, propriétés, mise en œuvre et applications (polyéthylènes, polypropylènes, polyesters, polyuréthanes, élastomères), 1982, 542 p.
- Exercices et travaux dirigés en sciences des polymères ;
- Mélanges de polymères, 1986, 292 p. ;
- Matériaux composites à base de polymères, 1989, 468 p. ;
- Structure des polymères et méthodes d’études, 1990, 580 p. ;
- Propriétés électriques des polymères et applications, 1993, 378 p.
- Groupe français d’études et d’applications des polymères, Synthèse, propriété et technologie des élastomères.
Maurice de Keghel, Traité général de la fabrication des colles, des glutinants et matières d’apprêts, Gauthier-Villars, Paris, 1959, 764 p.
- Pierre Grandou, Paul Pastour, Peintures & Vernis, Hermann, éditeurs des sciences et des arts, Paris, 1966, réédition 1988 en deux vol. : Les constituants : liants, solvants, plastifiants, pigments, colorants, charges, adjuvants, 946 p. (ISBN 978-2-7056-5520-4) et Techniques et industrie : types de revêtements, matériaux à peindre, utilisation, utilisateurs, spécialités, production, contrôle, vieillissement et des destructions des revêtements, 442 p. (ISBN 978-2-7056-5635-5)
- Robert Perrin, Jean-Pierre Scharff, Chimie industrielle, Masson, Paris, 1993, 1136 p. en deux tomes avec bibliographie et index (ISBN 978-2-225-84037-1) et (ISBN 978-2-225-84181-1)
- Bernard Lefrançois, Chimie industrielle, coll. Chimie CNAM, Technique et documentation, Lavoisier, t. 1, 1995, 638 p. (ISBN 978-2-85206-966-4). t. 2, 1996, 388 p. (ISBN 978-2-7430-0162-9) et t. 3, 634 p., 1999 (ISBN 978-2-7430-0350-0)
- Henri Fauduet, Principes fondamentaux du génie des procédés et de la technologie chimique, Technique et documentation, Lavoisier, Paris, 1997, 520 p. (ISBN 978-2-7430-0227-5)
- P. Anglaret, S. Kazmierczack, Technologie génie Chimique, CRDP d’Amiens, 1985, t. 1, 232 p. et t. 2, 202 p. (ISBN 978-2-86615-022-8)
- P. Anglaret, J. Filipi, S. Kazmierczack, Technologie génie Chimique, t. 3, CRDP d’Amiens, 1985 (ISBN 978-2-86615-036-5)
- André Buisson, Le schéma au service des techniques chimiques, 5e éd., coll. technique et industrie dirigée par Robert Pajot, Entreprise moderne d'édition, Paris, 1977, 150 p. (ISBN 978-2-7044-0582-4)
- Guy Linden, Denis Lorient, Biochimie agro-industrielle, valorisation alimentaire de la production, Masson, Paris, 1994, 368 p. (ISBN 978-2-225-84307-5)
- Jacques Mathieu, Initiation à la physico-chimie du lait, Technique et documentation, Lavoisier, Paris, 1998, 220 p. (ISBN 978-2-7430-0233-6)
- Luciano Usseglio-Tomasset, Chimie œnologique, 2e éd., Technique et documentation, Lavoisier, Paris, 1995, 388 p. (Traduction révisée par Alain Bertrand de Chimica Enologica, éd. AEB 1978/1995 (ISBN 978-2-7430-0059-2))
- Serge Kirkiacharian, Guide de chimie thérapeutique, Ellipses, Paris, 1996, 576 p. (ISBN 978-2-7298-4667-1)
- Michel Comet Michel Vidal, dir., Radiopharmaceutiques, chimie des radiotraceurs et applications biologiques, CNRS, Presses Universitaires de Grenoble, 1998, 744 p. (ISBN 978-2-7061-0774-0)
- Paul Rigny (dir. L’Actualité chimique Livres), Mélanie Spotheim-Maurizot, Mehran Mostafavi, Thierry Douki, Jacqueline Belloni (ed.), Radiation chemistry, from basics to applications in material and life sciences, EDP sciences, Les Ulys, France, 2008. 306 p. (ISBN 978-2-7598-0024-7)
- Laura Sigg, Werner Stumm, Philippe Behra, Chimie des milieux aquatiques, chimie des eaux naturelles et des interfaces dans l’environnement, 2e éd., Masson, Paris, 1994, 391 p., préface de F. Morel (ISBN 978-2-225-84498-0)
Revues, handbook et traités encyclopédiques |
Beilstein Handbook of Organic Chemistry, Chemical abstracts Service, Chemical Handbook, CRC Handbook of Chemistry and Physics
Ullmann's Encyclopedia of Industrial Chemistry, Traité Pascal
- Catalogues commerciaux de référence Merck, Fieser, Janssen, etc.
Actualité chimique, revue de la Société chimique de France (ancienne SFC)- R. H. Perry, D.W. Green (éd.), Perry's Chemical Engineers' Handbook (en), 8e éd., Chemical Engineering Series, McGraw-Hill, 2007 (ISBN 0-07-142294-3)
Le Guide de la Chimie, éd. Chimedit
Histoire et ouvrages jalons d’une époque |
- Fred Aftalion, Histoire de la chimie, Masson, Paris, 1988, 386 p. (ISBN 978-2-225-81420-4)
- Pierre Bianco, De la pile de Volta à la conquête de l'espace, deux siècles d'électrochimie 1799-1999, Publication de l'université de Provence, 1998, 266 p. (ISBN 978-2-85399-432-3)
- Laurence Lestel (coordination), Itinéraires de chimistes, 1857-2007, 150 ans de chimie en France avec les présidents de la SFC, éd. EDP Sciences et Société française de Chimie, 2008, 582 p. (ISBN 978-2-86883-915-2)
- Justus Liebig, La Chimie agricole, coll. Sciences du Comité des Travaux Historiques et Scientifiques, Paris, 2009. Texte traduit de la première parution allemande en 1840, présenté et annoté par Marika Blondel-Miegrelis (ISBN 978-2-7355-0504-3)
- Victor Regnault, Premiers éléments de chimie, 3e éd., Bibliothèque polytechnique, éd. Langlois et Leclercq, Victor Masson, Paris, 1855, 572 p.
- L. Troost, Traité élémentaire de chimie, Masson, Paris, 1880, 6e éd., 876 p.
- Louis Hackspill, Jean Besson, André Hérold, Traité de Chimie minérale, coll. Euclide, PUF, Paris, 1958
Liens externes |
- « La chimie au lycée », sur CNRS (consulté le 20 octobre 2014)
- « Ressources en Chimie », sur ENS (consulté le 20 octobre 2014)
- « Société chimique de France », sur SCF (consulté le 20 octobre 2014)
- « Les ressources de la chimie », sur Chimedit (consulté le 20 octobre 2014)
- (fr + en + de) « Société Suisse de Chimie », sur swiss-chem-soc.ch (consulté le 20 octobre 2014)
- (en) « Eric Weisstein's world of chemistry », sur http://scienceworld.wolfram.com (consulté le 20 octobre 2014)
- « Expériences de chimie amusante », sur scienceamusante.net (consulté le 20 octobre 2014)
- « La chimie pour tous », sur lachimie.fr (consulté le 20 octobre 2014)
- « cours et support didactique pour l'apprentissage de la chimie (niveau secondaire : collège et lycée) », sur lachimie.net (consulté le 20 octobre 2014)
- « Les Signets de la Bibliothèque nationale de France », sur bnf.fr (consulté le 20 octobre 2014)
- (fr + en + de + it) « Chimie générale on-line », sur chimge.epfl.ch/ (consulté le 20 octobre 2014)
- Portail de la chimie
- Portail des sciences
b0D JxWMZHl6qTnjBP5A2,hvNo
