Cetacea

Multi tool use
.mw-parser-output h1 #sous_titre_h1{display:block;font-size:0.7em;line-height:1.3em;margin:0.2em 0 0.1em 0.5em}Cétacés

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Mammalia |
| Infra-classe | Placentalia |
| Super-ordre | Laurasiatheria |
| Ordre | Cetartiodactyla |
| Sous-ordre | Cetancodonta |
Ordre ou Infra-ordre
Cetacea
Brisson, 1762
Les cétacés (Cetacea) forment un infra-ordre de mammifères aquatiques.
Il existe, en 2018, 89 espèces[1] (nombre non fixé car les chercheurs débattent encore sur le nombre de sous-espèces et la reconnaissance d'espèces cryptique)[2], dont plusieurs ont déjà disparu depuis les temps historiques. Seulement cinq espèces encore existantes sont dulçaquicoles. Ce taxon comprend les animaux les plus grands ayant existé sur Terre, dont les 14 espèces de baleines, notamment la baleine bleue. Ils sont considérés comme l'un des groupes d'espèces ayant le plus divergé des autres mammifères[3].
Ces espèces sont réputées pour avoir une intelligence remarquable. La discipline de zoologie qui les étudie s'appelle la cétologie.
Leur chasse a également joué un rôle économique important pour de nombreux pays, mais est à présent très limitée.
On a observé (par caméra) de grands cétacés jusqu'à près de 3 000 m de profondeur.

80 cétacés et l'homme (en bas à droite).

La baleine bleue est le plus gros animal actuel, et le plus lourd ayant jamais existé.
Sommaire
1 Taxonomie et dénomination
2 Classification
3 Phylogénie
3.1 Histoire évolutive et phylogénie au sein des cétartiodactyles
3.2 Phylogénie interne
4 Description
4.1 Morphologie
4.1.1 Les nageoires
5 Physiologie
5.1 Sens
5.2 Les organes et leurs fonctions
5.2.1 Le système respiratoire et circulatoire
5.2.2 Les muscles et le squelette
5.2.2.1 Le squelette
5.2.2.2 Les muscles
5.2.3 Le système tégumentaire
5.2.3.1 La peau
5.2.4 Le système uro-digestif
5.2.4.1 Osmorégulation
5.2.5 Le système digestif
5.2.6 Les organes reproducteurs
5.2.7 La thermorégulation
5.2.7.1 La graisse
5.2.8 Le système nerveux et sens
5.2.8.1 L'oreille et l'ouïe
5.2.8.2 La production des sons
5.2.8.3 Les yeux et la vue
5.2.8.4 Le cerveau
6 Chorologie
6.1 Espèces mutualistes
6.2 Espèces parasites
6.3 Les prédateurs
6.4 Maladies virales ou bactériennes, tumeurs, cancers
7 Les hybrides
8 Comportement
8.1 Comportement social
8.2 Communication
8.3 Stratégie alimentaire
8.4 Migration
9 Répartition
10 Les records
11 Les cétacés et l'Homme
11.1 Statut des espèces
11.1.1 Mise en place des protections
11.2 Les cétacés dans la culture
11.2.1 Nomenclature et étymologie
11.2.2 Le Whale-watching et la nage avec les cétacés
11.2.3 Les représentations de cétacés
12 Annexes
12.1 Articles connexes
12.2 Bibliographie
12.3 Références taxinomiques
12.4 Liens externes
13 Références
Taxonomie et dénomination |
Le substantif masculin cétacé est issu du grec ancien κῆτος [kêtos], et peut se traduire par « gros poisson de mer », baleine ou plus précisément monstre marin mais les espèces peuvent génériquement être appelées dauphin, baleine ou rorqual, en fonction de leur aspect[4]. Ces termes ne recoupent pas la classification scientifique qui distingue d'une part les cétacés à dents, taxon qui comporte des baleines (comme la baleine blanche) et des dauphins, et d'autre part les espèces de cétacés à fanons qui sont toutes, elles, qualifiés de baleines.
Outre ces deux noms génériques, des termes spécifiques sont utilisés pour nommer ces espèces ou groupes d'espèces comme béluga, cachalot, narval, orque ou épaulard, marsouin, rorqual, jubarte, sotalie et de termes issus du latin scientifique comme hypérodon, globicéphale. Ces noms vernaculaires ne désignent pas forcément non plus un taxon précis.
Carl von Linné avait classé les cétacés dans les plagiures, ce groupe comportait aussi les siréniens. Ce terme était utilisé depuis le XVe siècle au moins et rendait compte de leur queue très aplatie horizontalement. Il regroupait alors des animaux aquatiques, vus comme des poissons, à la queue plate, sans écailles, et avec des poumons.
Noter que Moby Dick (roman de Herman Melville publié en 1851), un grand cachalot, par conséquent un cétacé à dents, est parfois décrit comme une « baleine blanche » dans le texte. Le titre original de la première publication à Londres est The Whale, La Baleine. Au chapitre XXXII, Cetology, Melville se livre à un état des lieux des connaissances sur la classification des baleines et décide, en désaccord avec Linné (Systema Naturae, 1776 : « désormais je ne mentionnerai plus les cétacés parmi les poissons. », cité par Melville lui-même) d'appeler « poissons » les cachalots pourchassés dans son roman. Il alterne régulièrement entre les termes baleines et poissons.
Classification |
Aujourd'hui, les cétacés sont divisés en deux sous-ordres : les cétacés à fanons, appelés Mysticètes, et les cétacés à dents, appelés Odontocètes. La distinction entre les deux groupes n'est pas si simple cependant, aussi les taxonomistes se fondent sur plusieurs autres caractéristiques anatomiques pour différencier les espèces des deux groupes. Les narvals ne possèdent aucune dent visible à l'exception de deux dents qui, chez les mâles forment une ou exceptionnellement deux défenses[5]. Les grands cachalots ne possèdent pas de dents sur la mâchoire supérieure[6]. D'ailleurs le nom de genre des premiers monodons et le nom d'espèces des seconds, catodon, est à cet égard parlant.
Le taxon regroupe dix à quatorze familles selon les auteurs, par exemple les petits cachalots forment la famille des Kogiidae ou sont regroupés avec le grand cachalot au sein des Physeteridae. Les analyses phylogénétiques effectuées dans les années 1990 montrent que les cétacés à dents et les cétacés à fanons sont bien issus de la même lignée de mammifères marins. Aujourd'hui, la position des cétacés par rapport aux Artiodactyla est vivement discutée par les scientifiques.
Liste des familles établie d'après World Register of Marine Species (22 avril 2016)[7], Mammal Species of the World (version 3, 2005) (22 avril 2016)[8] et ITIS (22 avril 2016)[9] :
- sous-ordre Mysticeti Flower, 1864 (Mysticètes)
- famille Balaenidae Gray, 1821 — Baleines franches
- famille Balaenopteridae Gray, 1864 — Rorquals
- famille Eschrichtiidae Ellerman and Morrison-Scott, 1951 — Baleine grise
- famille Neobalaenidae Gray, 1873 — Baleine pygmée
- sous-ordre Odontoceti Flower, 1867 (Odontocètes)
- famille Delphinidae Gray, 1821 — Dauphins océaniques et Orques
- famille Monodontidae Gray, 1821 — Béluga et Narval
- famille Phocoenidae — Marsouins
- famille Physeteridae — Grand cachalot (ad minima)
- famille Platanistidae Gray, 1846 — Dauphins d'eau douce
- famille Ziphiidae Gray, 1850 — Baleines à bec et hypérodon
- famille Iniidae — Dauphin d'eau douce (placé dans Platanistidae par certains)
- famille Kogiidae — Petits cachalots (placé dans Physeteridae par certains)
- famille Lipotidae — Dauphin de Chine (placé dans Iniidae par certains, dans Platanistidae pour d'autres)
- famille Pontoporiidae Gray, 1870 — Dauphin de la Plata (placé dans Iniidae par certains, dans Platanistidae pour d'autres)
- famille Delphinidae Gray, 1821 — Dauphins océaniques et Orques
En outre, des dizaines de genres fossiles ont été identifiés ; par exemple Ambulocetus, Pakicetus, Basilosaurus, et classés sous le sous-ordre Archaeoceti.
Pour le parasitologue Laurent Soulier, l'étude des parasites pourrait montrer qu'au sein de chaque espèce il existerait des groupes qui se croisent sans jamais interagir entre eux, comme si ces groupes appartenaient à des espèces différentes.[réf. nécessaire]
Phylogénie |
Histoire évolutive et phylogénie au sein des cétartiodactyles |
Les cétacés ont pour ancêtre un animal terrestre. L'analyse phylogénétique des gènes codant certaines protéines mitochondriales[10] les a regroupés au sein d'un même clade avec les Artiodactyles (Ongulés à doigts pairs) dans le groupe des Cetartiodactyla. Ils sont donc plus proches des ruminants que des autres mammifères marins tels que les phoques et les loutres, plus proches des ours, ou des siréniens, plus proches des éléphants. Par ailleurs, l'étude de caractères dérivés dans leur génome nucléaire (les Rétrotransposons)[11] montre que leurs plus proches parents sont les hippopotames. Une étude basée sur la morphologie remet cependant en question cette proche parenté et suggère une plus grande proximité avec les anthracothères fossiles et une évolution des hippopotames à partir d'une autre branche, au sein des Cetartiodactyla à déterminer[12]. Les cétacés auraient donc divergé très tôt des anthracothères, à l'instar des suidés et des ruminants. Il faut cependant préciser que cette étude n'a inclus que des représentants fossiles des cétacés, des archéocètes qui ne sont eux-mêmes pas ancêtres des cétacés actuels.
Les plus anciens fossiles connus datent d'environ 60 Ma. Le taxon comprend environ 80 espèces dont plus de la moitié sont de répartition mondiale. Leur origine commune a été très discutée, mais une étude phylogénique a montré qu'ils dérivent d'une espèce commune. Les cétacés à fanons sont issus d'un groupe qui s'est différencié des cétacés à dents au cours de l'Éocène.
Phylogénie des familles actuelles de cétartiodactyles (hors cétacés), d'après Price et al., 2005[13] et Spaulding et al., 2009[14]:
Cetartiodactyla |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Phylogénie interne |
Phylogénie des familles actuelles des cétacés modernes (néocètes) d'après Gatesy et al. (2012)[15]:
| Cetacea→Neoceti |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Eubalaena glacialis (Balaenidae).

Megaptera novaeangliae (Balaenopteridae).

Eschrichtius robustus (Eschrichtiidae).

Caperea marginata (Neobalaenidae).

Tursiops truncatus (Delphinidae).

Inia geoffrensis (Iniidae).

Kogia sima (Kogiidae).

Lipotes vexillifer (Lipotidae).

Delphinapterus leucas (Monodontidae).

Phocoenoides dalli (Phocoenidae).

Physeter macrocephalus (Physeteridae).

Platanista gangetica (Platanistidae).

Pontoporia blainvillei (Pontoporiidae).

Mesoplodon bidens (Ziphiidae).

Squelette de Xiphiacetus (espèce fossile).
Description |

Comparaison de taille entre une baleine bleue, un dauphin d'Hector et un homme.

Exemple, une baleine de Minke
Baleine crème
1. Mâchoire supérieure
2. Évent
3. Peau noire, blanche ou grise
4. Nageoire dorsale en forme de faucille
5. Entaille médiane
6. Nageoire caudale
7. Dessous gris pâle ou blanc
8. Les nageoires ont des points
9. Bande blanche sur chaque nageoire
10. 50 à 70 sillons ventraux
11. Museau à points
Morphologie |
Les cétacés partagent tous un certain nombre de caractères morphologiques, un corps lisse et fuselé, ce qui facilite la pénétration dans l'eau, un système pileux quasi inexistant, l'absence de griffes, pas d'oreilles externes et le conduit auditif est fermé[3]. Les membres antérieurs et la queue des cétacés ont évolué en nageoires. La nageoire caudale appelée palette, très puissante, est horizontale, contrairement à celles des poissons. Elle assure la propulsion tandis que les nageoires latérales assurent l'équilibre et le maintien de la direction. L'aileron dorsal fait office de stabilisateur comme la quille d'un bateau. Comme les autres mammifères, les cétacés respirent à l'aide de poumons et doivent régulièrement faire surface pour respirer avec leur évent situé au sommet du crâne.
Le dimorphisme sexuel observé pour ces espèces est principalement lié à la taille, les mâles odontocètes sont en général plus grands que les femelles, mais ce n'est pas le cas par exemple chez les botos[16] et chez la plupart des mysticètes dont la baleine bleue[17]. Les mâles de certaines espèces d'odontocètes, comme les Ziphiidae ou surtout le narval, possèdent une dentition différente des femelles[3].
La livrée des cétacés est adaptée au mode de vie de l'animal. Elle peut être asymétrique gauche-droite comme pour le rorqual commun. Pour plusieurs espèces, elle permet de reconnaître les spécimens. La plupart des cétacés océaniques ont le dos foncé et le ventre blanc, de façon que les proies et les prédateurs les confondent avec le fond de la mer lorsqu'ils les voient de dessus et ne voient qu'un reflet de la surface de l'eau lorsqu'ils les voient par dessous.
Des caractéristiques morphologiques permettent de reconnaitre les espèces, voire les individus, cependant l'observation des cétacés est difficile, du fait de leur vitesse et de leur méfiance vis-à-vis de l'homme. Les analyses génétiques permettent de résoudre cette difficulté : en effet, à chaque plongeon les cétacés laissent des squams, des résidus huileux ou des excréments qui flottent. Ceux-ci peuvent être analysés. Les espèces peuvent également être identifiées par leurs chants, toutes les espèces ne produisant pas des vocalises identiques.
Les spécimens de certaines espèces peuvent être facilement reconnus par les taches sur leur peau. Ainsi les spécimens de certaines espèces peuvent être reconnus uniquement par les taches sur leur nageoire caudale. Les baleines les plus grandes peuvent être aussi reconnues par la forme de l'implantation des balanes sur leur peau ou la forme de leurs nageoires. Les marques sur la peau, souvent présentes chez les mâles car résultant de combats, permettent aussi d'identifier les individus.
Selon Alexey V. Yablokov, la livrée des cétacés est liée à leur mode de vie, ainsi les cétacés aux livrées plus ou moins uniformes seraient planctophages, les livrées des espèces au ventral dégradé clair seraient sociales et les espèces aux livrées contrastées seraient des chasseurs.
| Désignation |
Mysticètes |
Odontocètes |
|---|---|---|
Évent |
Ouverture nasale double |
Ouverture nasale unique |
| sillons ventraux |
présent pour quelques espèces |
absent |
rostre |
absent |
plus ou moins long selon les espèces |
Les nageoires |

Nageoire caudale de baleine dans l'Atlantique nord.
Les cétacés possèdent deux nageoires pectorales ou palettes natatoires thoraciques, une nageoire dorsale ou aileron et une nageoire caudale ou queue. Les nageoires pectorales permettent aux cétacés de s'orienter. Il semble que la nageoire dorsale permettent une plus grande efficacité dans les mouvements. Les nageoires dorsales de certains épaulards mâles peuvent dépasser deux mètres. Megaptera novaeangliae dispose quant à elle des plus grandes nageoires pectorales, celles-ci peuvent atteindre le tiers de leurs corps[18].
La progression est due à la pression sur l'eau d'une nageoire caudale de forme homocerque. Celle-ci est orientée horizontalement (alors qu'elle est verticale chez les poissons osseux et cartilagineux). La pression de la queue sur l'eau est exercée verticalement, le sens de mouvement de cette nageoire favoriserait les déplacements de ces animaux du fond vers la surface et inversement. Le marsouin de Dall, un des cétacés les plus rapides, a été mesuré à 55 km/h[19], l'orque pourrait l'être encore plus. Hormis les siréniens, les autres mammifères marins ne possèdent pas de queue qui permette le mouvement.
Physiologie |
Les cétacés doivent remonter à la surface pour respirer, y compris lorsqu'ils dorment. Leurs phases de sommeil sont courtes, environ un quart d'heure et s'étalent sur toute la journée, mais certains cétacés peuvent être observés inactifs en mer durant de longues périodes. Les cétacés semblent ne jamais entrer en sommeil paradoxal[20] car on suppose qu'ils doivent garder du tonus musculaire pour assurer qu'un mouvement permettant la respiration soit possible. Chez certaines espèces de cétacés, ainsi que chez certaines espèces d'oiseaux, chaque hémisphère cérébral assure à son tour cette fonction[21], le sommeil est unilatéral[22].
Sens |
Le sens[23] le plus développé chez les cétacés est l'audition, particulièrement chez les cétacés à dents qui sont dotés de la fonction d'écholocation, sorte de sonar naturel. Diverses mutations dans les domaines transmembranaires et cytosoliques de la prestine, protéine très abondante dans la paroi de certains cils de l'oreille interne ont été rapportées chez différentes espèces de Chiroptères et se sont révélées convergentes avec celles observées chez le grand dauphin[24]. Cependant, la démonstration fonctionnelle de l'implication de ces mutations dans le mécanisme de l'écholocalisation n'a pour l'instant pas été apportée. Les odontocètes émettent des clics d'écholocation dont une partie est réfléchie par les obstacles. L'analyse de ces retours leur donne une sorte d'image acoustique de leur environnement. La présence de ce type de sens est beaucoup moins développée chez les baleines à fanons, mais des signes semblent montrer qu'elles n'en sont pas dépourvues.
Leur vue n'est pas mauvaise, même si elle n'est pas leur sens principal. Elle est beaucoup plus mauvaise pour les dauphins de rivières, certaines espèces sont même presque aveugles, pour les autres, elle est efficace sous l'eau ou hors de l'eau. Certains cétacés sortent la tête de l'eau pour observer les oiseaux et en déduire où se trouvent les bancs de poissons. Les cétacés des delphinariums sont capables de localiser des objets à plusieurs mètres au-dessus du niveau de l'eau et de s'en saisir. Les odontocètes semblent avoir perdu leur odorat, et il est vraisemblablement très réduit chez les mysticètes. Les globes olfactifs du cerveau ne semblent présent que chez les embryons. D'ailleurs, les chémorécepteurs comme l'organe de Jacobson sont atrophiés chez les mysticètes et absents chez les odontocètes.
Ce sens est compensé par un sens du goût, ainsi les grands dauphins sont capables de détecter par exemple des phéromones, des poissons...
Ce même dauphin, s'il semble posséder moins de récepteurs chimiques permettant le goût, est, en revanche, plus sensible aux variations de salinité et surtout d'amertume.
Si toutes les espèces naissent avec des poils sur leurs rostres, seules certaines espèces de mysticètes gardent des vibrisses à l'âge adulte. En revanche toutes ces espèces ressentent les contacts, la chaleur, leur position relative dans l'espace.
Une hypothèse appuyée sur de nombreux indices, mais encore à préciser est que les cétacés disposent d'un sens magnétique analogue à celui des oiseaux ou des tortues marines[25]. De la magnétite a en effet été trouvée, connectée à des neurones dans leur dure-mère[25]. Ils l'utiliseraient pour migrer sur de longues distances. Les relevés par satellite des baleines à bosse au large de l'archipel d'Hawaï montre que les trajectoires de ces dernières suivent le nord magnétique avec une grande précision. Certains expliquent par des erreurs dues à ce sens, les échouages, régulièrement observés (depuis l'Antiquité au moins). Dans un certain nombre de cas, une corrélation a été trouvée entre anomalies magnétiques au sol et zones fréquente d'échouage. Dans certains cas et/ou chez certains individus, la pollution et/ou des interférences liées à l'activité solaire pourraient provoquer une méprise magnétique et provoquer des échouages[25].
| Sens |
Mysticètes |
Odontocètes |
|---|---|---|
| écholocation |
soupçonnée |
présente |
| odorat |
absent |
soupçonné ou très réduit |
| sens magnétique |
inconnu |
soupçonné |
Les organes et leurs fonctions |
Les ancêtres des cétacés, en quelques millions d'années se sont adaptés du milieu terrestre au milieu marin. À partir d'une morphologie terrestre proche des artiodactyles, ils ont perdu certaines caractéristiques pour en gagner d'autres[23]. Comme chez les ruminants et autres ongulés, les cétacés possèdent trois bronches, trois poches stomacales, pas de clavicule, etc[3]. Mais les adaptations au milieu aquatique comme celle du squelette et surtout les adaptations liées aux sens et celles liées aux capacités hyperbares pour certaines espèces sont très originales. On peut tout de même citer l'absence de glande sébacée, la présence d'une couche de graisse importante, les poumons et le foie non lobés, un diaphragme oblique[3]... L'étude de l'anatomie des grandes espèces est particulièrement malaisée du fait de la taille imposante des animaux et donc des organes, le cœur d'une baleine bleue adulte pèse plus de 500 kilogrammes.
Les nageoires pectorales sont le résultat de l'évolution des membres supérieurs des cétacés, à ce titre, elle contiennent des os internes qui rappellent les os des pattes des mammifères terrestres. Les autres nageoires, dorsale ou caudale, sont en revanche dépourvues d'os et de muscles mais sont constituées de tissus fibreux rigides extrêmement solides. Les tissus de la nageoire caudale sont enveloppés de ligaments inextensibles et très solides attachés aux vertèbres.
Le génome des cétacés est diploïde, ils ont 42 ou 44 chromosomes[3].
Le système respiratoire et circulatoire |

Baleine bleue projetant un panache d'eau lors de son expiration en surface.
Le système respiratoire et circulatoire des cétacés est remarquablement efficace. Il doit répondre à deux objectifs pour la majorité des espèces, à savoir assurer des plongées les plus longues possible et de supporter des pressions élevées. Les performances mesurées au sein de ce taxon sont cependant très variées, les dauphins dulçaquicoles n'ont en effet pas besoin de descendre très profondément et donc pas besoin de plonger longtemps. La plus longue plongée enregistrée pour un sousouc n'est que de 180 secondes[26] ainsi que de 460 secondes pour une orque mais de 3 780 secondes pour une baleine boréale[27], soit 21 fois plus longtemps que pour le sousouc.
La trachée et les bronches sont séparées, ce qui implique que les cétacés ne peuvent respirer que par les évents. La respiration est contrôlée et volontaire et non pas réflexe, si l'animal est anesthésié sans ventilation pulmonaire active ou ses évents bouchés, il meurt. Ils peuvent respirer relativement vite, un grand dauphin respire trois fois par minute. L'évent est partiellement fermé pendant les expirations et grand ouvert pendant les inspirations. Les expirations expulsent de l'air chaud, mêlé de vapeur d'eau, ce qui en région froide, produit des panaches visibles de loin à cause de la condensation de l'eau. Les cétacés utilisent 80 à 90 % de leur volume pulmonaire, contre 10 à 15 % environ pour l'homme, ce qui leur permet d'extraire 12 % de l'oxygène qu'ils inhalent contre 4 %, classiquement chez les mammifères terrestres.
Le volume sanguin des cétacés est élevé puisqu'il représente 15 % du poids de leur corps, contre 7 % chez les humains. En outre, il dispose de deux fois plus d'hématies et de myoglobines[3] que ces derniers. Ils sont également capables de contrôler l'alimentation en oxygène des organes non vitaux comme les intestins[3]. La fréquence de battements de cœur de certains d'entre eux baisse à 80 par minute en plongée[3].
Le Rete mirabile est bien développé comme pour tous les mammifères marins. Il l'est surtout dans la cage thoracique où il forme un plexus sous la plèvre, entre les côtes et de chaque côté de la colonne vertébrale. Il est également développé dans l'aire à la base du crâne[3]. Les dispositions et mécanismes des veines et artères autour du cœur, qui est relativement aplati, ont pour but de ralentir le retour du sang veineux et donc de réduire la fréquence de battement.
En général, les mammifères marins ont proportionnellement des plus petits poumons que les autres mammifères, ceux des cétacés sont particulièrement élastiques et placés dorsalement dans la cage thoracique. Ils reposent sur un diaphragme plus long et placé plus horizontalement que chez les autres mammifères. Ils plongent donc avec relativement peu d'air en comparaison de leur volume total. Il plongent d'autant plus facilement que leur masse volumique est plus élevée sans un grand volume d'air. Les humains qui plongent en utilisant des bouteilles, malgré leur lourd équipement, doivent ajouter des plombs à leurs accessoires pour arriver à descendre. Lors de la descente, l'air vicié repasse du sang aux poumons, évitant aux gaz de stationner dans le système sanguin. Ils expirent donc dans l'eau lors de la plongée pour évacuer les surplus de gaz. Il semblerait que les grands cachalots sécrètent également une « huile » fixant l'azote du sang[réf. nécessaire]. Ainsi, ils ne craignent donc ni l'ivresse des profondeurs et ne sont que rarement victimes d'accidents de décompression.
Comme chez les plongeurs professionnels humains, on peut observer une ostéonécrose c'est-à-dire une nécrose des tissus cartilagineux au niveau des articulations. C'est une conséquence de l'accumulation de l'azote qui provoque de minuscules accidents de décompression[28]. Certains experts estiment que les grands cachalots qui peuvent plonger à plus de 2 500 mètres pendant plusieurs heures observent des paliers de décompression.
Les muscles et le squelette |
Le squelette |

Squelette de baleine bleue.
Les modifications au niveau du squelette sont nettement visibles et sont analogues sur plusieurs points à celles des siréniens, mais il s'agit d'une convergence évolutive[réf. nécessaire]. Le rôle du squelette, n'est pas de porter le corps, mais de servir de support aux ligaments. Le poids moyen de leur squelette a été évalué à 17 % soit un peu plus que ceux des hommes, évalué à 15 %, mais moins que ceux des éléphants, évalué à 20 %.
Les membres pelviens sont considérablement réduits : il ne reste plus que quelques os pelviens résiduels auxquels est relié le muscle ischio-caverneux qui maintient le pénis en place à l'intérieur de la fente génitale chez les mâles. Ce muscle est analogue à celui retrouvé chez les autres mammifères dont, entre autres, les ongulés et l'Homme. En revanche, les membres thoraciques sont conservés, quoique atrophiés, et l'on retrouve la scapula (« omoplate » de l'Homme), l'humérus, le radius, l'ulna (anciennement « cubitus »), les os du carpe, les métacarpes et les phalanges qui se sont multipliées, on parle d'hyperphalangie. Les membres supérieurs ne sont pas mobiles les uns vis-à-vis les autres à part pour l'épaule. La clavicule est absente comme elle l'est chez les autres ongulés[3]. Le tout forme une nageoire pectorale, équivalente à celle des poissons et dont le rôle n'est pas la propulsion mais le maintien de l'équilibre dans l'espace et la direction des mouvements. Les autres nageoires ne sont pas ossifiées.

Mâchoire de Baleine conservée au Muséum de Toulouse, par Eugène Trutat.
Parmi les autres caractéristiques observées, on observe un cou court et peu flexible, les vertèbres sacrées n'ont pas fusionné.
C'est au niveau du crâne que l'on différencie principalement les odontocètes des mysticètes : ces derniers ont un crâne symétrique. Les os de la face (maxillaire, incisif, mandibule, etc.) se sont allongés et se télescopent avec les os du crâne sur la face dorsale du crâne pour former ce que l'on appelle l'évent, issu de la migration sur la face dorsale des narines osseuses au cours de l'Oligocène.
Les côtes sont très fines voir absentes, sauf chez la baleine pygmée[23]. Cette adaptation confère un avantage important pour les plongées profondes[23]. Le nombre de phalanges dépend des espèces mais est toutefois important, permettant de rigidifier les nageoires pectorales de grande taille[23].
Il n'y a pas d'os dans les nageoires dorsale et caudale en revanche, les nageoires pectorales en contiennent et ils sont les homologues de ceux, par exemple, de la main humaine. De très rares spécimens disposent d'embryons de nageoires à moitié arrière du corps, parallèlement aux nageoires pectorales, ce sont, selon la théorie de l'évolution, des vestiges des membres arrière, peu à peu atrophiés au fil des générations.
| Mysticètes |
Odontocètes |
|---|---|
| Absence de dents (sauf à l’état embryonnaire), présence de fanons |
Présence de dents, quelquefois présentes simplement dans la gencive |
Crâne symétrique |
Crâne asymétrique |
| Absence de côtes sternales |
Présence de côtes sternales |
Sternum composé d'un os unique qui s’articule uniquement sur la première paire de côtes |
Sternum composé de trois os s’articulant avec trois paires de côtes ou plus |
L'attache des muscles dorsaux au squelette varie énormément entre les différentes familles, c'est un des critères possibles d'identification de celles-ci.
Les muscles |
La chair est particulièrement foncée, car les muscles sont riches en myoglobine. La musculature est particulièrement développée puisqu'elle représente 40 % de la masse corporelle de la baleine bleue et 54 % du rorqual boréal[23]. L'organisation de la musculature est foncièrement différente de celle des autres mammifères, les muscles peauciers peuvent être réduits mais leur masse peut être importante.
Le système tégumentaire |
- Les fanons des mysticètes sont fixés sur les mâchoires supérieures, les plus longs fanons des plus grandes espèces sont supérieurs à 1,5 mètre de large. Ces fanons leur servent à filtrer ce que contient leur bouche en expulsant l'eau.
- Les cétacés sont homodontes c'est-à-dire que leurs dents, sauf exception comme le narval qui en principe ne possède qu'une défense, sont identiques entre elles. La denture est très différente parmi les espèces de ce groupe, mais les embryons de toutes ces espèces disposent de dents. Les mysticètes perdent ces dents avant leur naissance, tandis que certaines espèces de Platanistidae en ont plus de 120[29]. Les dents de lait des odontocètes ne tombent pas, la seconde série reste atrophiée. Les dents des odontocètes servent à agripper les proies et leur forme dépend de leur régime alimentaire. Ainsi, leur nombre et leur forme permet aux spécialistes d'en déduire l'espèce. Les cétacés avec des dents sont plutôt piscivores, ceux sans dents sont plutôt consommateurs de céphalopodes.
- Des poils sensitifs sont fixés sur les commissures de la bouche pour les mysticètes.
| Mysticètes |
Odontocètes |
|---|---|
| présence de fanons |
présence de dents, au moins deux |
| présence de poils |
absence de poils |
La peau |
La peau est composée de quatre couches dont les épaisseurs sont différentes de celle des autres mammifères. La couche épidermique des cétacés atteint 2 à 4 millimètres en moyenne, et 12 millimètres chez le bélouga. L'épiderme est composé de tissu conjonctif dense et est en général dépourvu de follicules pileux et de glandes sébacées. Certaines zones, pour certaines espèces, sont encore équipées de poils sensibles. La couche épidermique est fine, lisse et élastique et exsude de l'huile qui augmente leur hydrodynamisme. Cette adaptation est également présente chez de nombreux poissons. Ainsi les mysticètes peuvent atteindre des vitesses de 26 km/h et les odontocètes des vitesses supérieures à 30 km/h[3]. Le paradoxe de James Gray, qui stipule que les muscles des cétacés sont insuffisamment puissants pour permettre à ceux-ci de se déplacer aux vitesses observées est aujourd'hui caduc[30], les muscles le sont. Plusieurs hypothèses pour expliquer l'inadéquation musculaire supposée à leur vitesse réelle ont été formées. L'une d'elles proposait qu'il se formait à la surface de la peau une multitude de rides minuscules qui dirigent le flux de l'eau en évitant la création de micro-turbulences qui freineraient ces animaux, permettant de conserver un écoulement régulier de l'eau favorisant un glissement dans l'eau avec peu d'efforts.
Le derme est composé de tissus conjonctifs d'une épaisseur formée par quelques cellules. L'hypoderme est lui plus épais, il est poreux et inextensible[23]. La concentration en graisse y est importante, ainsi l'hypoderme de la Baleine Bleue est constitué de 62 % de graisse soit 15 à 20 tonnes au total[23]. La proportion en graisse varie entre les couches extérieures et les couches intérieures. La quantité de graisse varie elle en fonction des saisons, des migrations, de la quantité de nourriture disponible. Comme chez les autres mammifères, cette couche sert de réserve énergétique. C'est dans cette couche que l'on retrouve les grandes accumulations de certains polluants (liposolubles) auxquels sont soumis les cétacés (PCB, dioxines, furanes, certains pesticides et autres organochlorés[31]). Cette couche contient des tissus conjonctifs intermédiaires et est très vascularisée. Ce système permet aux cétacés de contrôler leur température interne. La quatrième couche, le Stratum germinativum est constituée d'un Épithélium pavimenteux et les mélanocytes y sont fixés.
La peau des cétacés est aussi sensible au toucher.
Lorsqu'ils remontent près de la surface, la peau des cétacés est sensible, comme toutes les peaux des mammifères sans fourrure, aux rayons du Soleil. Des études scientifiques menées sur des baleines bleues, des grands cachalots et des rorquals communs ont révélé en 2010 que certaines lésions cutanées font suite à un coup de soleil, sans que néanmoins des cancers de la peau aient pu être observés[32]. Sur la courte durée des observations, ces lésions semblent être en augmentation. Aucune explication précise n'est à ce jour fournie, la réduction de la couche d'ozone est une des causes possibles[32].
Le système uro-digestif |
Osmorégulation |
L'eau de mer est un milieu hypertonique, c'est-à-dire que les cellules des organismes marins doivent sans cesse lutter contre la perte naturelle de leur eau. Cette lutte nécessite une adaptation au moins aussi poussée que celle des mammifères vivant dans les zones très arides[33]. Il existe assez peu d'études sur ce sujet pour ces animaux[33].
La concentration en sel dans leur urine est supérieure à celle de l'eau de mer. Les cétacés boivent cependant très peu d'eau de mer, selon une étude de 1970, entre 4,5 et 13 ml par kg et par jour[33]. Ces espèces ne règlent pas leur concentration interne en sels par l'absorption de l'eau de mer[33]. Même les espèces vivant en eau douce gardent la capacité à augmenter la salinité de leur urine en réponse à un stimulus hypertonique.
Seuls parmi les mammifères, les reins des cétacés, des pinnipèdes, des loutres ou des ours ont une structure réniculée[33]. Ces reins sont constitués d'une multitude de petits lobes qui contiennent des tissus corticaux et une pyramide rénale insérée dans un seul calice. La structure des reins ne permet pas d'expliquer leur performance, la raison de leur performance est vraisemblablement due au mécanisme de régulation hormonale de la concentration d'urine[33].
Le système digestif |
Les cétacés sont carnivores pourtant leur système digestif ressemble à ceux des ruminants du sous-ordre des Sélénodontes, il possède trois poches[3]. Ils n'ont pas de vésicule biliaire[3]. Le foie est non lobé.
La première poche stomacale est un assez grand et musculeux estomac mécanique qui broie les aliments. Cela est d'autant plus nécessaire que leurs dents, quand ils en ont, ne sont pas destinées à broyer la nourriture.
La seconde poche est la plus grande, les sucs digestifs commençant à dissoudre la nourriture.
L'estomac pylorique est le plus petit des trois estomacs, commence là l'assimilation des substances nutritives. Cet estomac est suivi d'une ampoule duodénale, puis du duodénum.
Les organes reproducteurs |
Les organes génitaux sont internes, situés derrière la fente génitale, chez les mâles comme les femelles si bien qu'il est parfois difficile de distinguer le sexe des spécimens. Les testicules des mâles sont également dans cette poche. L'utérus des femelles est constitué de deux parties comme chez les autres ongulés et les carnivores, les mamelles, plates, élongées et extractibles, se trouvent près de la fente génitale. Le placenta est épithéliochorial[3].
Chez les femelles des cétacés, contrairement aux autres mammifères, les corps blancs ne disparaissent pas et témoignent de l'histoire reproductive de chaque animal. Les cétologues peuvent ainsi estimer le nombre de gestations d'un cétacé.
La thermorégulation |
La graisse |
La couche de graisse sous-cutanée, généralement très épaisse, permet d'éviter la déperdition de chaleur, épouse la forme du corps et équilibre le poids de ce dernier, augmente la flottabilité. Le pannicule de certaines baleines peut atteindre 30 cm.
Le système nerveux et sens |
L'oreille et l'ouïe |
Les cétacés n'ont plus d'oreilles externes mais se servent, en plus des osselets habituels aux mammifères, de petits os dans la mandibule qui transmettent les sons grâce au coussin adipeux qui entoure l'os tympanique. L'oreille interne est isolée par une ampoule contenant de l'air. Les variations de densité de toutes ces structures indiquent à l'animal d'où vient le son. Le nombre de cellules qui innervent l'oreille — deux ou trois fois plus élevé que chez l'homme — et la taille importante du nerf auditif indiquent que les cétacés parviennent très bien à discriminer les tons et les ondes sonores à haute fréquence et surtout le lieu de leur provenance.
La production des sons |
Les cétacés peuvent produire un grand nombre de son destinés à communiquer comme la production de bulles, de sifflements, de bruit de battements de nageoire, de vocalises et de trombes avec leur évents, mais pas seulement pour communiquer. Le sonar nécessite l'émission de cliquetis pour fonctionner. Le grand cachalot et l'orque ainsi que quelques espèces de dauphins sont capables d'étourdir et de paralyser les poissons et les calmars avec de puissantes ondes sonores.
Les yeux et la vue |
Les yeux des cétacés n'ont pas de canal lacrymal mais sont protégés par une huile sécrétée par des glandes situées près des paupières ; celles-ci sont épaisses et souvent peu mobiles[34]. Les yeux sont souvent petits par rapport à la taille de l'animal en comparaison de ceux des primates par exemple. La sclère est très épaisse, particulièrement à l'arrière de l'œil dans la zone du nerf optique ce qui réduit encore le volume du globe oculaire et donc l'acuité visuelle. Le cristallin est presque sphérique.
L'arrière de la rétine est constitué d'un tapetum lucidum, de type cellulosum choroïdien, une zone richement vascularisée qui permet d'accroitre la quantité de lumière qui se dirige vers la rétine, autrement dit cela accroit la vision dans l'obscurité. La rétine contient des cônes et des bâtonnets, ce qui leur permet de détecter les couleurs, mais les cônes ne représentent que 1 % des photo-récepteurs et ceux sensibles aux faibles longueurs d'onde ont disparu. Bien que cette question soit sujette à controverse[35], la vision des couleurs ne leur est certainement possible que dans certaines circonstances. Tous les cétacés étudiés, comme les phoques ont perdu certains pigments rétiniens au cours de l'évolution, ce qui fait que pour eux, l'eau n'apparait pas bleue[36]. Les phoques et les baleines étant deux groupes taxonomiques assez éloignés, le fait qu'ils soient tous deux touchés plaide à la fois pour une évolution convergente et un avantage adaptatif de ce trait dans l'environnement visuel marin[36].
Les yeux sont disposés latéralement ce qui rend la vision stéréoscopique impossible pour certaines espèces. Les Delphinidae peuvent bouger, tel les caméléons leurs yeux indépendamment[37]. Les grands dauphins peuvent même focaliser leurs yeux et les zones de chevauchement leur permettraient de percevoir les objets en relief[37].
Mais, même si ce n'est pas leur organe sensoriel principal, ils n'en sont pas pour autant atrophiés. Le grand Dauphin sait même adapter sa vision hors de l'eau de sorte[35] qu'en observant le vol des oiseaux de mer, il peut repérer les bancs de poissons.
Le cerveau |
Le cerveau des cétacés est très performant. Avec les éléphants[38] et les primates[39], les cétacés font partie des rares animaux dont la conscience d'eux-mêmes a été scientifiquement mise en évidence. Les expériences sur le grand dauphin montrent qu'ils sont également capables de se mettre à la place d'un humain, d'apprendre, d'inventer mais ils ont également conscience de leurs propres états de la connaissance (métacognition)[40]. D'autre part, on sait que les cétacés sont capables de communiquer, que tous les groupes d'une même espèce n'utilisent pas forcément les mêmes signaux, y compris vocaux, pour communiquer[41], de maîtriser une grammaire[42] et même, pour certaines espèces au moins, de pouvoir nommer par vocalise un partenaire. Le cerveau des cétacés a évolué alors qu'ils étaient déjà mammifères marins, d'une façon indépendante de celui des primates depuis 95 Ma[43] et il est donc remarquable qu'il permette des performances comparables à celles des primates sur ces points. C'est un remarquable exemple de convergence évolutive.
En fait le néocortex des cétacés surpasse par son degré de gyrification celui de tous les autres mammifères, y compris des humains. L'épaisseur des différentes couches du néocortex diffère cependant de celle des primates, la I et la IV sont plus minces, la II plus dense. En fait la connectivité intra-hémisphérique semble favorisée[44] chez les cachalots par exemple. Le cerveau des cétacés se caractérise aussi par la forte densité des cellules gliales[44]. Ceci rend les cerveaux des cétacés très différents de ceux des espèces terrestres même si, curieusement les corticaux préfrontaux responsables des fonctions cognitives élevées comme l'attention, le jugement, l'intuition, et la conscience sociale, sont à la même position que ceux des primates[44].
Chorologie |
Espèces mutualistes |
De nombreux exemples d'entraide pour la pêche ont été observés, témoignant de l'opportunisme et de l'intelligence de ces espèces. Ainsi des baleines à bosse collaborent entre elles pour rabattre des bancs de poissons avec l'aide de thons, des grands dauphins collaborent avec des humains sur les plages du Sénégal. Ces mêmes dauphins peuvent collaborer avec des goélands pour les mêmes raisons. Quelques espèces mutualistes se nourrissent des ectoparasites par exemple le poisson nettoyeur appelé capucette barré consomme les « poux de baleines » des baleines grises.
Espèces parasites |
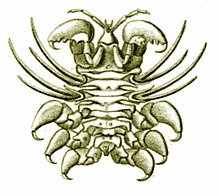
L'un des ectoparasites des grands cétacés (cyame ovale, mâle). Ses puissantes griffes lui permettent de s'ancrer dans la peau de la baleine, souvent autour des orifices ou des blessures. Il se nourrit de la peau superficielle[45].
Les cétacés sont hôtes de très nombreuses espèces de parasites, internes ou externes. Ils peuvent être cleptoparasite ou quelquefois victimes de ces pratiques du fait par exemple des oiseaux de mer, de rémoras ou de poissons-pilotes bien que leur intelligence les protège quelque peu. Les parasites seraient responsables de la mort de 25 % des cétacés de Méditerranée. Non pas qu'ils tuent directement leur hôtes, seuls certains parasites particulièrement pathogènes le font, mais leur prolifération devient pathologique sur les animaux faibles ou immunodéprimés[46], ce qui finit par les tuer.
Des cestodes Tetrabothrium et Diplogonoporus parasitent leurs intestins, des plérocercoïdes Phyllobothrium et Monorygma parasitent leur péritoine et leur peau, des trématodes comme ceux des genres Bolbosoma et Corynosoma parasitent leurs estomacs, leur foie, leurs intestins, leurs sinus, des vers acanthocéphales parasitent leurs intestins, des nématodes comme ceux des genres Anisakis, Crassicauda, et Placentonema parasitent également leurs estomacs et leurs voies génitales. Les voies respiratoires sont parasitées par des nématodes de la famille Pseudaliidae.
Certains des parasites externes sont de grande taille comme le squalelet féroce ou les lamproies. Certains crustacés parasites, Rhizocephala et copépodes dont Balaenophilus unisetus et les Pennella, colonisent leur peau et leur graisse. Des nématodes comme Odontobius ceti, des protozoaires vivent également sur la peau. Des crustacés amphipodes dits « poux de baleine », les Cyamidae consomment la peau des cétacés sur lesquels ils vivent (ou les parties blessées purulentes). Ils sont rares chez les dauphins et étaient très nombreux autrefois sur les baleines, surtout en été. Ils se déplacent en s'encrant profondément dans la peau au moyen de leurs longues griffes. La diatomée Cocconeis ceticola, qui n'est pas a proprement parler un parasite provoque des plaques de couleurs sur la peau.
Les balanes de genre Coronula et Conchoderma par exemple se fixent sur la peau, voire les fanons des espèces les plus grandes. Ce ne sont pas à proprement parler des parasites, ils ne semblent pas occasionner de désavantage à ces baleines[47].
L'analyse de ces parasites donnent aux scientifiques des informations sur l'espèce hôte et des informations biogéographiques[46].
Les prédateurs |

illustration du XVIe siècle montrant une orque attaquant une baleine
Les cétacés ont peu de prédateurs naturels.
Disparu il y a 1,6 Ma, le plus grand requin ayant jamais existé le mégalodon a pu être un prédateur de cétacés, des traces de dents ont été découverts sur des fossiles de diverses baleines. Aujourd'hui, tous les cétacés sont susceptibles de subir des attaques d'orque, ceux-ci attaquent même les juvéniles de baleines bleues en les noyant. Les grands requins tels que le requin tigre ou le requin blanc sont également des prédateurs possibles. Les morses ainsi que l'ours polaire sont occasionnellement prédateurs de cétacés, principalement des bélougas ou des narvals. Les cétacés à fanon ont pour principale défense leur masse, qui généralement dissuade les prédateurs, cependant un requin des grandes profondeurs (-1 000 à −4 000 m), dit requin emporte-pièce, rarement observé a une forme de bouche et de mâchoire qui lui permet de prélever des morceaux de chair de grands cétacés, durant leurs migrations. Ses morsures habituellement non-mortelles laissent des cicatrices « en cratères » (un rorqual boréal avait 138 de ces cicatrices)[48]. Face à leurs prédateurs naturels, les odontocètes comptent davantage sur la cohérence de leur groupe, sur leur vitesse et sur leur agilité.
Les humains restent le prédateur le plus redoutable des cétacés, que cette chasse soit artisanale ou industrielle.
Les petits cétacés ont été chassés pour leur viande, et en tant que concurrents de la pêche ou parce qu'ils faisaient des dégâts dans les filets en s'y prenant accidentellement ou en cherchant à y manger des poissons[49], ce qui les a fait considérer comme nuisibles par certains.
Dans les années 1920, l'ichtyologiste Le Gall (Agrégé de l'Université, Directeur du laboratoire de l'office scientifique et technique des pêches maritimes de Boulogne-sur-mer, et correspondant du CIEM, en Poste à Boulogne sur mer), pouvait ainsi écrire que les pêcheries sardinières de l'Atlantique « redoutent, avec juste raison, les visites dangereuses que leur font les nombreux Cétacés delphinidés (Dauphins, marsouins, etc.) attirés sur nos côtes pendant les mois d'été par la présence des bancs de sardines. Ces Mammifères, désignés par les pêcheurs sous le nom général de Bélugas (nom inexact (…)), commettent de tels dégâts dans les pêcheries que les pouvoirs publics s'en sont émus et que diverses tentatives ont été faites, sans grand résultat d'ailleurs, pour essayer de s'en débarrasser. Jusqu'ici, seuls l'emploi du fusil et de la mitraille semblent avoir donné des résultats assez appréciables. Mais dans ce cas, l'animal blessé ou tué s'enfuit ou coule et involontairement les pêcheurs laissent s'échapper une bonne aubaine »[49].
La chair du marsouin, foncée et dotée d'un goût assez fort a été prisée durant plusieurs siècles, par toutes les classes sociales, vendue salée, fumée ou fraiche sur les marchés[49]. La langue, le filet, la cervelle, le foie et les rognons ont été particulièrement appréciés[49]. Tombée en désuétude en France, elle était encore au début du XXe siècle appréciée et consommée en Angleterre, en Italie, aux États-Unis, dont sous forme de conserves de Cétacés au Canada[49]. Le Gall disait ceci de la défaveur récemment faite à la viande de marsouin en France : « injustifiée », elle « doit donc disparaître, la chair du marsouin doit retrouver sur le marché aux poissons la place qu'elle occupait autrefois, et ce serait peut-être le meilleur moyen d'atténuer la pullulation de ces hôtes indésirés. Le pêcheur alléché par l'attrait non seulement d'une prime, mais encore d'une vente certaine, n'hésiterait pas à se livrer à la chasse du Cétacé et, directement intéressé, s'occuperait bien vite des meilleurs moyens pour le capturer »[49]. Il recommande pour cela l'emploi de la senne tournante à grandes mailles et surtout le fusil lance-harpon inventé en Norvège par M Krohnstad[50] en 1923 et testé avec succès en 1924[49].
Maladies virales ou bactériennes, tumeurs, cancers |
Les cétacés peuvent être victimes de séquelles de l'ingestion de plastique[51] et porteurs nombreux types de blessures, susceptibles de s'infecter ou de se surinfecter (combats contre des orques ou requins, capture dans des filets, blessures dues à des hélices de bateaux[52] ou à des collisions avec des bateaux[53]...) et certaines pathologies de cétacés semblent en augmentation, notamment en raison de la pollution marine et/ou de manque de nourriture dans les zones de surpêche[54],[55].
Des Cétacés (dauphins notamment) porteurs de lésions cutanées[56], de divers malformations[57],[58] (parfois dues à des mutations), abcès[59], d'angiomes et hémangiomes[60] et de plusieurs types de cancers et métastases ont été observés de par le monde (néoplasies[61], séminomes[62], phéochromocytome, lymphomes[63]...)[55]. En tant que superprédateurs, ils sont exposés à la bioconcentration dans le réseau trophique de nombreux polluants.
Un Morbillivirus semblable à la maladie de Carré, au début des années 1990 a causé en Méditerranée une épidémie qui a tué en masse les odontocètes, en particulier les dauphins bleu et blanc. Il semble que cette surmortalité a été causée par l'accumulation de plusieurs maladies dues à de mauvaises conditions climatiques, à une fragilisation des organismes liée aux pollutions chimiques, à une diminution des ressources alimentaires. D'autres virus comme des Adenovirus, des Poxviridae, des Hepadnavirus, des Herpesviridae et grippes peuvent être transmis à l'homme et mortels, pour eux ou pour nous. De même, les cétacés peuvent également être porteurs de virus moins dangereux comme des Calicivirus, des Papillomavirus, Picornavirus et Morbillivirus.
Les cétacés semblent sensibles à la bactérie Erysipelothrix rhusiopathiae[64]. Brucella maris est pathogène pour l'ensemble des mammifères marins. Plusieurs Vibrio et Pseudomonas pseudomallei sont des bactéries pouvant causer des zoonoses.
Parce qu'ils sont susceptibles de transmettre leurs maladies ou d'attraper les nôtres (mycoses notamment[65]), ce qui pourrait avoir dans un sens comme dans l'autre des conséquences imprévisibles, il est recommandé de ne pas toucher les cétacés[66], pas plus d'ailleurs que pour tout autre animal sauvage, même si celui-ci vient vers vous.
Les hybrides |
Comme chez les autres mammifères, les cas d'hybridation naturelle semblent rares chez les cétacés, en comparaison de ceux observés chez les oiseaux par exemple. Quelques cas d'hybridations spontanées ou induites par une présence commune en delphinarium sont cependant connus. Une étude a confirmé que des femelles marsouins de Dall peuvent occasionnellement s'hybrider avec des marsouins commun, ces accouplements semblent dépendre principalement de facteurs écologiques provoquant un isolement reproductif qui pousse les mâles à poursuivre les femelles[67]. En 2008, un hybride de rorqual et de baleine à bosse aurait été observé puis photographiée à Rurutu (Polynésie)[68].
Plusieurs whalphins issus d'une fausse orque (Pseudorca crassidens) et d'un grand dauphin (Tursiops truncatus) sont nés en captivité.
Comportement |
Le comportement des cétacés est d'une façon générale mal connu, du fait de leur crainte de l'homme, de leur extrême mobilité et, pour les espèces marines au moins, de leur environnement peu favorable à la présence de l'homme. Les cétacés sont les seuls amniotes, avec les siréniens, à vivre tout leur cycle de vie dans l'eau, les autres espèces aquatiques de ce groupe, comme les manchots, les crocodiliens ou les phoques doivent au moins revenir à terre pour faire naitre leur petit, et que les hippopotames amphibies, dont la parturition est aquatique, doivent retournent à terre pour se nourrir.
Comportement social |
La plupart des espèces de cétacés sont grégaires, et ils chassent souvent en groupe[69], le nombre d'individus dans les groupes — aussi appelés pods — peut fortement varier, ainsi certaines orques chassent par trois ou quatre, d'autres en groupe comptant plus d'une dizaine d'individus. Pour cette espèce, leur nombre dépend du type de proies chassées. Le marsouin de Dall est communément observé par groupe de 20, mais des groupes de plus de 200 individus ont été observés[19]. Le boto est lui plutôt solitaire[16]. Certaines espèces comme les dauphins à long bec[70] ou les dauphins bleu et blanc[71] peuvent côtoyer des espèces plus grandes comme les rorquals au sein de groupes plus ou moins grands. Plusieurs espèces aiment nager auprès des plus grosses ou des bateaux, devant l'étrave ou derrière la poupe, profitant du sillage pour se déplacer à moindre effort, pour chercher une protection ou pour jouer en surfant sur les sillons provoqués par les gros volumes. Au sein des groupes, tous les individus n'ont pas le même rôle social. Chez les Tursiops, certains individus favorisent même les relations entre les sous-groupes, autrement dit, la cohérence globale du groupe[72]. Une hiérarchie existe entre les individus, et entre les trois générations : juvéniles, subadultes, adultes. Les individus de la même espèce au sein d'un groupe sont la plupart du temps très solidaires[73], n'hésitant pas à aider les malades. La plupart des espèces grégaires regroupent leurs petits au sein de nurseries pendant que les adultes chassent, certaines d'entre elles, comme celles des dauphins à long bec[70] ou le bleu blanc[74] peuvent regrouper des centaines de petits. Cependant les conflits entre mâles au sein d'un groupe, entre groupes différents, voir entre espèces peuvent-être violents.
Les cétacés sont carnivores et la plupart du temps diurnes, le dauphin à long bec est cependant connu pour chasser la nuit[3].
La plupart des espèces étudiées sont polyandres, polygynes ou polygynandres. Parfois le comportement sexuel, comme celui de la baleine franche de l'Atlantique Nord est connu, car la parade nuptiale et l'accouplement se déroulent près de la surface[75]. La plupart des espèces de cétacés n'ont qu'une seule saison de reproduction par an. Les femelles donnent naissance à un nouveau-né tous les un à six ans, après 10 à 17 mois de gestation[3]. Beaucoup d'espèces migrent vers l'équateur pour mettre bas, notamment plusieurs mysticètes qui jeûnent durant toute cette saison et qui repartent avec leur petit se nourrir vers les pôles après quelques semaines. Habituellement, les naissances ont lieu en saison chaude. Les nouveau-nés sont précoces, ils sortent par le siège de l'utérus et doivent immédiatement nager pour regagner la surface. Les femelles allaitent les petits sur les périodes qui s'étalent selon les espèces de six mois à deux ans, du moins pour le grand cachalot[6]. Les mères sont très maternelles mais les mâles ne s'occupent en général pas des petits, bien que quelques cas où des mâles jouant et apportant de la nourriture à des jeunes ont été observés. Chez certaines espèces, comme le béluga, les mères et leurs jeunes peuvent former des associations qui durent longtemps après que ceux-ci sont sevrés[3]. Les jeunes n'atteignent leur maturité sexuelle qu'après plusieurs années, une dizaine en moyenne pour les mysticètes. Même après avoir atteint la maturité sexuelle, les jeunes doivent attendre plusieurs années avant qu'ils soient socialement intégrés et placés dans une situation où la reproduction est permise.
Communication |
Les cétacés sont vraisemblablement tous capables de communiquer entre eux, quelquefois à très grandes distances et de transmettre des informations complexes.
Ainsi les grands dauphins identifient un congénère car ils ont des vocalises spécifiques qui varient selon les circonstances du groupe, les caractérisant eux-mêmes ; c'est ainsi qu'ils sont capables d'identifier la signature vocale des différents individus de leur groupe[76]. Les orques possèdent des techniques de chasses propres à un groupe, qu'ils peuvent enseigner à un nouvel arrivant. Leur langage basé sur des sifflements bruyants et des ultrasons inaudibles pour l'oreille humaine semble être très élaboré mais est encore mal compris.
- Communication gestuelle
- vocalisation et autres sons comme des grincement de dent chez les belugas par exemple[77]
- Communication émotionnelle (détection des émotions avec le sonar)
Stratégie alimentaire |
Migration |
Les cétacés peuvent nager en formation en V pour diminuer les efforts lors de migrations durant plusieurs milliers de kilomètres.
Répartition |
On trouve des cétacés dans toutes les mers du monde et outre dans les rivières d'Asie, d'Amérique du Sud et du nord. La répartition de certaines espèces est mondiale, comme les orques ; d'autres se cantonnent à un hémisphère comme les baleines de Minke, à un océan comme le Lagenorhynchus obliquidens. Certaines espèces sont fortement migratrices, d'autres très sédentaires.
Quelques espèces vivent très près des pôles, dans des eaux très froides. Ces cétacés sont en général de plus grande taille que la moyenne. Ces espèces ont un taux métabolique plus faible et comparativement, disposent d'une plus petite surface de peau en comparaison de leur volume sanguin ce qui leur permet de moins perdre de chaleur, et enfin elles disposent d'une imposante couche de graisse.
Les records |
- La baleine bleue, ou rorqual bleu, est l'animal le plus grand ayant vécu sur Terre, pouvant dépasser 30 m de long et atteindre 170 tonnes; elle cumule de nombreux records comme celui du plus grand pénis (env. 2 mètres).
- Le grand cachalot est l'animal à dents le plus grand ayant vécu sur Terre.
- La baleine boréale est certainement le mammifère qui vit le plus longtemps, un spécimen a été daté de 115 à 130 ans[78], ces baleines pourraient vivre 200 ans.
- Le grand cachalot est le tétrapode plongeant le plus profond ; il a été observé à 2 035 m[79]
- Le record mondial de durée de plongée pour un animal à poumon est détenue par une bérardie d’Arnoux, une plongée a été mesurée à 9180 secondes soit 2 heures 33 minutes[80].
- La baleine à bosse détient le record de distance annuellement parcourue chez les mammifères avec environ 25 000 kilomètres[81].
- les laits de cétacés, et en particulier celui du béluga, sont parmi les plus gras des laits de mammifères avec plus de 500 grammes de graisse par litre.
Globicephala melas est le mammifère actuel possédant le plus grand nombre de neurones corticaux[réf. nécessaire].- Certains cétacés n'ont pas de dents tandis que certains Platanistidae en ont plus de cent vingt[29], ce qui représente un record pour les mammifères.
Les cétacés et l'Homme |
Statut des espèces |

Observation des baleines au large de la côte de Péninsule Valdés (Argentine). En 1999, la presqu'île de Valdés a été inscrite sur la liste du patrimoine mondial de l'UNESCO.
En 2005, l'UNESCO reconnaissait que « plus de deux tiers des dauphins, des marsouins et autres espèces de la famille des cétacés sont en danger d’être abattus ou pris dans des filets »[82]. En 2007, l'UICN a déclaré probablement disparu le dauphin de Chine[83], tandis que selon elle, en 2008, une espèce est considérée comme en danger critique d'extinction, le marsouin du Golfe de Californie[84]. Sept autres espèces sont classées par cet organisme comme en danger, le rorqual boréal[85], la baleine bleue[86], le rorqual commun[87], le dauphin de Nouvelle-Zélande[88], la baleine franche de l'Atlantique Nord[89], la baleine franche du Pacifique Nord[90], le sousouc[91]. Cinq espèces, uniquement à dents, sont classées vulnérables. Bien que les effectifs de nombreuses espèces soient en déclin, plusieurs espèces, après avoir été grandement menacées comme la baleine boréale[92] ou la baleine bleue, ont ces effectifs en augmentation. Ainsi par exemple la population de baleines boréales qui atteint au moins 10 000[92] spécimens en 2006 augmente de 3 à 5 % par an, alors qu'elle se situait vraisemblablement à près de 50 000 individus avant les campagnes de chasse.
L'augmentation du trafic maritime et l'apparition de navires à grande vitesse s'accompagnent d'une pollution sonore sous-marine croissante et d'une augmentation du risque de collision avec des cétacés[93] ou de blessures par hélice ou filets. Les cétacés le splus gros peuvent être tués par des chocs avec les gros bateaux ; peu de précautions semblent prises par les armateurs pour éviter ces chocs mortels pour les cétacés mais peu dommageables pour les grands navires.
Les sonars militaires utilisant des systèmes d'écholocation comparables à ceux des cétacés marins à forte puissance, peuvent les tuer (Aux Bahamas en 2000, une expérience de l'US Navy avec un émetteur à 230 dB dans la gamme de fréquence 3 000 à 7 000 hertz provoqua l'échouage de seize baleines, dont sept furent trouvées mortes. L'US Navy reconnut sa responsabilité dans cet échouage dans un rapport publié dans le Boston Globe, le 1er janvier 2002). Les sonars pourraient leur faire perdre leur sens de l'orientation, voire les empêcher de se nourrir ou de se reproduire. Ils pourraient provoquer des malaises de décompression, ce qui occasionne ensuite des échouages.
La chasse à la baleine (encore aujourd’hui pratiquée par les Japonais et Islandais) a fait chuter d'une manière importante les populations de certaines espèces comme le globicéphale tropical, la fausse orque, le dauphin bleu et blanc, le dauphin d'Électre. La viande de ces espèces y est vendue sous l'appellation « viande de baleine ».
Des menaces indirectes sont la pollution marine et la surpêche qui affectent les ressources alimentaires des cétacés. Ces menaces ne touchent pas uniformément chacune des espèces (selon leur position dans le réseau trophique). En outre, plusieurs associations écologistes et la FAO[94] dénoncent également les mortalités occasionnées par les filets dérivants, pratique qui se poursuit en 2008, même dans les endroits où elle a été interdite, comme en Méditerranée[95]. Depuis les années 1990, des pingers sont expérimentés avec un certain succès pour éloigner les dauphins et surtout les marsouins des filets. Le Whale-watching souvent pratiqué in situ et en période de reproduction peut aussi perturber leur vie.
Les museums, aquariums publics et diverses associations cherchent à mieux faire connaitre les cétacés[96].
Mise en place des protections |
La Commission baleinière internationale condamne la chasse à la baleine, sauf dans quelques cas particuliers et justifiés, pour lesquels elle accorde des permis de chasse. Plusieurs pays comme la Nouvelle Zélande, le Canada ou les Etats-Unis (parmi d'autres) ont intégré dans leurs lois des régulations concernant l'approche et l'attitude à adopter près des cétacés. Dans de nombreuses régions, des chartes et des codes de bonne conduite[66] sont en place, ainsi que des label pour une observation des baleines durable. Une zone pour protéger les mysticètes a été créé en 1979 dans l’Océan Indien puis une autre autour de l'Antarctique en 1994, les deux sanctuaires ont une zone contiguë. Un espace maritime protégé pour tous les types de cétacés leur est consacré en Méditerranée : le Sanctuaire Pelagos qui résulte d'un accord signé en 1999 par la France, l'Italie et Monaco pour la protection des mammifères marins qui le fréquentent.
- Accord sur la Conservation des petits cétacés dans la mer Baltique et la mer du Nord
- Accord sur la conservation des cétacés de la mer Noire, de la Méditerranée et de la zone Atlantique adjacente
- Sanctuaires : Pelagos (Mediterrannée), Agoa (Antilles), Antarctique, Basse Californie...
- Mesures de régulations, charte, code de bonne conduite
- Dispositifs de réduction des collisions grands cétacés/bateaux [97]
- Pinger (halieutique)
- Dispositif de harcèlement acoustique
De nombreuses associations comme la Société pour la conservation des baleines et des dauphins
Les cétacés dans la culture |
Nomenclature et étymologie |
Liste alphabétique des noms vernaculaires qui peuvent être donnés aux cétacés en français :
Baleine
- Bélouga
- Cachalot
Dauphin
- Globicéphale
- Marsouin
- Narval
- Orque
Rorqual
- etc.
Le Whale-watching et la nage avec les cétacés |
L'observation des baleines ou whale-watching a pour but d'observer les cétacés dans leur milieu naturel, à des fins touristiques. Cette activité, plus rarement dénommée « tourisme baleinier », est une activité en plein développement depuis les années 1990. Pratiquée de façon raisonnable, durable et dans le respect de l'environnement marin et de sa faune, cette activité offre un réel intérêt à l'éducation, à la sensibilisation du public et à la protection des cétacés. Non encadrée et pratiquée par des opérateurs non, ou mal, formés, elle peut avoir de forts impacts sur le comportement, la survie et la reproduction des populations de mammifères marins[98],[99]. La nage est quant à elle une activité particulièrement controversée. Les études posent de grandes inquiétudes sur la soutenabilité de ces pratiques pour les animaux [100], mais aussi sur la sécurité des pratiquants.
Les représentations de cétacés |
Les plus anciennes représentations connues des cétacés sont datées de 6 à 10 000 ans, ce sont des peintures rupestres découvertes en Corée du Sud qui représentent des scènes de chasse[101]. Dans l'Antiquité, les gros cétacés sont avant tout des monstres marins, thème que l'on retrouve dans la Bible ou dans Pinocchio, les dauphins sont au contraire représentés sur de nombreuses fresques romaines assez fidèlement. Arion de Méthymne est sauvé par un dauphin.
La chasse à la baleine, de par son danger, a été le centre de nombreuses œuvres, la plus célèbre étant Moby Dick. Après la moitié du XXe siècle et le début de la prise de conscience des menaces pesant sur les cétacés, les dauphins sont devenus populaires. Une série télévisuelle, Flipper le dauphin, a reçu un accueil particulièrement favorable. Par la suite des centres d'élevage, appelés delphinariums, sont apparus, contribuant à faire de ces animaux des animaux « sympathiques ».
Voir aussi : Liste des cétacés de fiction
Annexes |
.mw-parser-output .autres-projets ul{margin:0;padding:0}.mw-parser-output .autres-projets li{list-style-type:none;list-style-image:none;margin:0.2em 0;text-indent:0;padding-left:24px;min-height:20px;text-align:left}.mw-parser-output .autres-projets .titre{text-align:center;margin:0.2em 0}.mw-parser-output .autres-projets li a{font-style:italic}
Articles connexes |
- Photo-guide taxinomique de la faune et de la flore sous-marine
- Intelligence des cétacés
- Histoire des cétacés
Échouage des cétacés, Explosion de baleine
Bibliographie |
- Frédéric Cuvier et Georges-Louis Leclerc Buffon, De l'histoire naturelle des cétacés, ou recueil et examen des faits dont se compose l'histoire naturelle de ces animaux: recueil et examen des faits dont se compose l'histoire naturelle de ces animaux, Roret, 1836(lire en ligne)
- (en) cetacean stranding in the Mediterranean sea, Tunis, Centre d’Activités Régionales pour les Aires Spécialement Protégées (CAR/ASP), 76 p. (lire en ligne)
- (en) Guido Dehnhardt, « Sensory systems », dans A. Rus Hoelzel, Marine Mammal Biology : An Evolutionary Approach, Blackwell Publishing, 2002(ISBN 0-632-05232-5), p. 116-141
- (en) Annalisa Berta et al., Marine Mammals : Evolutionary Biology, Academic Press (réimpr. 3a [1999], 2006), 547 p. (ISBN 0-12-088552-2)
- (en) Rudy M. Ortiz, « Osmoregulation in Marine Mammals », The Journal of Experimental Biology, vol. 204, 2001, p. 1831-1844 (lire en ligne)
(en) Guide sur les aires protégées et la protection des cétacés dans le monde
- Olivier Adam, Dorian Cazau, Cétacés. Nouvelles connaissances issues de la recherche française, éditions Dirac, 2017, 160 p.
- Daniel Robineau, Cétacés de France, Fédération Française des Sociétés de Sciences Naturelles, Collection Faune de France (n°89), 2005, 646 p. (ISBN 2-903052-25-5)
Références taxinomiques |
- (en) Référence World Register of Marine Species : taxon Cetacea Brisson, 1762 (+ liste familles + liste genres)
- (en) Référence Mammal Species of the World (version 3, 2005) : CETACEA Brisson, 1762
- (en) Référence Paleobiology Database : Cetacea
- (en) Référence North American Mammals : Cetacea
- (fr+en) Référence ITIS : Cetacea Brisson, 1762 ( )
- (en) Référence Tree of Life Web Project : Cetacea
- (en) Référence Animal Diversity Web : Cetacea
- (en) Référence uBio : Cetacea Brisson, 1762
- Référence Catalogue of Life : Cetacea
- (en) Référence NCBI : Cetacea
Liens externes |
Notices d'autorité : Bibliothèque nationale de France (données) • Gemeinsame Normdatei
(fr) Le Groupe de Recherche sur les Cétacés
- Site complet consacré aux cétacés, nombreuses vidéos et photos
- Site complet sur les dauphins et les cétacés en général, nombreuses vidéos
- Site d'informations sur les baleines et les mammifères marins
- Le site officiel du Sanctuaire Pelagos, pour les mammifères marins en Méditerranée
- « La peau des dauphins », sur chambon.ac-versailles.fr
- Un site Web au sujet des dauphins et de tout autre cetacea
- « Site d'informations sur les bioindicateurs, pollution sonore, signaux acoustiques (sons de cétacés) »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 18 septembre 2017)
« Classification des cétacés du monde », sur marchaldauphins.com, liste des noms vernaculaires.- (en) L Marino, RC Connor, RE Fordyce, LM Herman, PR Hof et al., « Cetaceans Have Complex Brains for Complex Cognition », PLoS Biology, vol. 5, no 5, 2007(lire en ligne)
- (en) Michel C. Milinkovitch et Olivier Lambert, « Cetacea », sur Tree of Life web projetc
- Gaëlle, François et Franck, Les cétacés, biologie et comportement, d’Océan-Océan et Réseau Cétacés (lire en ligne), p. 37
La conservation des cétacés, convention sur les espèces migratrices (lire en ligne), p. 24Brochure
(en) RICHARD L. MALVINZ et MARTIN RAYNER, « Renal function and blood chemistry in Cetaceal », American revue of phyxology, vol. 214, no I, janvier 1968(lire en ligne).- document conjoint WDCS et CMS
Références |
(it) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en italien intitulé « Cetacea » (voir la liste des auteurs).
(en) « The World Cetacea Database », sur marinespecies.org (consulté le 26 juin 2018).
(en) James G. Mead, « Biodiversity in cetaceans », in R. Arai, M. Kato and Y.Doi (eds.), Biodiversity and Evolution, The National Science Museum Foundation, 1995, p.41–46
(ADW, 2008)
Jean-Pierre Sylvestre, Révision des noms de cétacés en usage au Québec et termes employés dans leur étude page 73
(en) Référence Animal Diversity Web : Monodon monoceros
(en) Référence Animal Diversity Web : Physeter catodon
World Register of Marine Species, consulté le 22 avril 2016
Mammal Species of the World (version 3, 2005), consulté le 22 avril 2016
ITIS, consulté le 22 avril 2016
(en) Dan Graur et Desmond G. Higgins, « Molecular evidence for the inclusion of cetaceans within the order Artiodactyla, D Graur », Molecular Biology and Evolution, 1994(résumé)
(en) Shimamura et al., « Molecular evidence from retroposons that whales form a clade within even-toed ungulates. », Nature, 1997(résumé)
(en) Boisserie et al., « The position of Hippopotamidae within Cetartiodactyla », PNAS, 2005(résumé)
(en) Price SA, Bininda-Emonds OR, Gittleman JL, « A complete phylogeny of the whales, dolphins and even-toed hoofed mammals (Cetartiodactyla) », Biol Rev Camb Philos Soc., vol. 80, no 3, août 2005, p. 445-473 (DOI 10.1017/S1464793105006743, lire en ligne)
(en) M Spaulding, MA O'Leary et J Gatesy, « Relationships of Cetacea (Artiodactyla) Among Mammals: Increased Taxon Sampling Alters Interpretations of Key Fossils and Character Evolution », PLoS ONE, vol. 4, no 9, 2009, e7062 (PMID 19774069, PMCID 2740860, DOI 10.1371/journal.pone.0007062, Bibcode 2009PLoSO...4.7062S)
(en) John Gatesy, Jonathan H. Geisler, Joseph Chang, Carl Buell, Annalisa Berta, Robert W. Meredith, Mark S. Springer et Michael R. McGowen, « A phylogenetic blueprint for a modern whale », Molecular Phylogenetics and Evolution, vol. 66, no 2, 2012, p. 479–506 (PMID 23103570, DOI 10.1016/j.ympev.2012.10.012, lire en ligne)
(en) Référence Animal Diversity Web : Inia geoffrensis
(en) Référence Animal Diversity Web : Balaenoptera musculus
Randy Frahm, The Humpback Whale, Capstone Press, 1999, p. 12-13, (ISBN 0-7368-8487-4)
(en) Référence Animal Diversity Web : Phocoenoides dalli
« Le cerveau dédoublé du dauphin », sur sommeil.univ-lyon1.fr/
Sommeil, Encyclopaedia Universalis
Mehdi Tafti, « Le cerveau dédoublé du dauphin » (consulté le 26 mars 2013)
M. Macé, Éléments d'Anatomie et de Physiologie des Cétacés, Sète, Cours E.P.H.E., 1995-2007 (lire en ligne)
Ying Li, Zhen Liu, Peng Shi et Jianzhi Zhang, « The hearing gene Prestin unites echolocating bats and whales », Current Biology, vol. 20, no 2, 2010, R55-R56 (PMID 20129037, DOI 10.1016/j.cub.2009.11.042)
DAS Krishna (1996), Les échouages de cétacés : une méprise magnétique ? ; Cahiers d'Ethologie ; avec orbi.ulg.ac.be. PDF, 5pp.
(en) G Pilleri, « Observations on the Behaviour of Platanista gangetica in the Indus and Brahmaputra Rivers », Invest Cetacea, vol. 2, 1970, p. 27-60 record répertorié dans (en) « Susu », sur The penguiness book (consulté en novembre 2008)
(en) GK Krutzikowsky et BR Mate, « Dive and surfacing characteristics of bowhead whales (Balaena mysticetus) in the Beaufort and Chukchi seas », Canadian Journal of Zoology, vol. 78, 2000, p. 1182-1198 record répertorié dans (en) « Bowhead Whale », sur The penguiness book (consulté en novembre 2008)
« Le cachalot, un plongeur comme les autres ! », sur futura-sciences.com, 21 janvier 2005
(en) Référence Animal Diversity Web : Platanistidae
Laurent Sacco, « Vitesse des dauphins : la fin du paradoxe de Gray », sur Futura-Sciences, 26 novembre 2008
Alzieu, claude et Duguy Raymond (1978) Teneurs en composés organochlorés chez les cétacés et pinnipèdes fréquentant les côtes françaises, 12 mai 1978 PDF 64pp, avec archimer.ifremer.fr
Claire Peltier, « Les baleines souffrent aussi de coups de soleil », Futura-Sciences, 14 novembre 2010
(Ortiz, C. L. 2001)
(en) John Hunter (Médecin), Observations on Certain Parts of the Animal Oeconomy, Inclusive of Several Papers from the Philosophical Transactions, Etc, 1er janvier 1837(lire en ligne)
(Dehnhardt 2002, p. 131)
Peichl, L., Behrmann, G., & KroÈger, R. H. (2001). For whales and seals the ocean is not blue : a visual pigment loss in marine mammals. European Journal of Neuroscience, 13(8), 1520-1528 (résumé)
(Berta, 1999, p. 154)
(en) Joshua M. Plotnik, FBM de Waal et Diana Reiss, « Self-recognition in an Asian elephant », Proc Natl Acad Sci, vol. 103, 2006, p. 17053–17057 (résumé)
(en) D Reiss et L Marino, « Self-recognition in the bottlenose dolphin: A case of cognitive convergence », Proc Natl Acad Sci, vol. 98, 2001, p. 5937–5942. (résumé)
(en) JD Smith, J Schull, J Strote, K McGee, R Egnor et al., « The uncertain response in the bottlenose dolphin (Tursiops truncatus) », Journal of Experimental Psychology, vol. 124, no 4, 1995, p. 391–408
(en) LE Rendell et H Whitehead, « Vocal clans in sperm whales (Physeter macrocephalus) », Proc Biol Sci, vol. 270, no 1512, 2003, p. 225–231 (résumé)
(en) LM Herman, DG Richards et JP Wolz, « Comprehension of sentences by bottlenosed dolphins », Cognition, vol. 16, 1984, p. 129–219. (résumé)
(en) S Kumar et Blair Hedges S, « A molecular timescale for vertebrate evolution », Nature, vol. 392, 1998, p. 917–920 (résumé).
(en) L Marino, RC Connor, RE Fordyce, LM Herman, PR Hof et al., « Cetaceans Have Complex Brains for Complex Cognition », PloS Biology (consulté le 23 février 2018)
Anales des sciences naturelles, digitalisées par Google, en Ligne
(Cetacean stranding in Mediterranean sea, p. 26)
(Berta, 2006, p. 140)
Mysterious deep-sea sharks biting chunks out of migrating whales, New Scientist, News, 15 avril 2016
Le gall, La pêche en Norvège (Notes de mission), Mémoires ; Office scientifique et technique de pêches maritimes, 81 pages. Série spéciale N°4 ; Ed Blondel La Rougerie ; Paris. (Il s'agit du compte rendu d'une mission d'études des techniques de pêche en Norvège, réalisée à la demande du « Syndicat des Armateurs boulonnais » pour étudier la possibilité pour l'industrie harenguière boulonnaise d'aller directement pêcher le hareng en Norvège au lieu de l'importer.
Fiskeriassistant au Fiskerimuseet de Bergen
Denuncio, P., R. Bastida, M. Dassis, G. Giardino, M. Gerpe and D. Rodriguez, (2011). Plastic ingestion in Franciscana dolphins, Pontoporia blainvillei (Gervais and d'Orbigny, 1844), from Argentina. Mar. Pollut. Bull., 62: 1836-1841
Byard, R.W., C. Winskog, A. Machado and W. Boardman (2012) The assessment of lethal propeller strike injuries in sea mammals. J. Forensic Legal Med., 19: 158-161.
Martinez, E. and K.A. Stockin (2013) Blunt trauma observed in a common dolphin (Delphinus sp.) likely caused by a vessel collision in the Hauraki Gulf, New Zealand. Pacific Conservat. Biol., 19: 19-27
Alaa Eldin Eissa & Ashraf M. Abu-Seida (2015) Synopsis on the Most Common Pathologies of Dolphins. Journal of Fisheries and Aquatic Science, 10: 307-322. DOI: 10.3923/jfas.2015.307.322 URL: http://scialert.net/abstract/?doi=jfas.2015.307.322
Alaa Eldin Eissa & Ashraf M. Abu-Seida (2015) Synopsis on the Most Common Pathologies of Dolphins. Journal of Fisheries and Aquatic Science, 10: 307-322. DOI: 10.3923/jfas.2015.307.322 URL: http://scialert.net/abstract/?doi=jfas.2015.307.322
Hart, L.B., D.S. Rotstein, R.S. Wells, J. Allen and A. Barleycorn et al., (2012). Skin lesions on common bottlenose dolphins (Tursiops truncatus) from three sites in the Northwest Atlantic, USA. PLoS One, Vol.
DeLynn, R., G. Lovewell, R.S. Wells and G. Early, (2011) Congenital scoliosis of a bottlenose dolphin. J. Wildl. Dis., 47: 979-983
Dabin, W., C. Cesarini, I. Clemenceau, F. Dhermain, T. Jauniaux, O. Van Canneyt and V. Ridoux, (2004). Double-faced monster in the bottlenosed dolphin (Tursiops truncatus) found in the Mediterranean sea. Vet. Rec., 154: 306-308
Cassle, S.E., E.D. Jensen, C.R. Smith, J.M. Meegan and S.P. Johnson et al., (2013) Diagnosis and successful treatment of a lung abscess associated with Brucella species infection in a bottlenose dolphin (Tursiops truncatus). J. Zoo Wildl. Med., 44: 495-499
Diaz-Delgado, J., M. Arbelo, S. Sacchini, O. Quesada-Canales, M. Andrada, M. Rivero and A. Fernandez, (2012) Pulmonary angiomatosis and hemangioma in common dolphins (Delphinus delphis) stranded in Canary Islands. J. Vet. Med. Sci., 74: 1063-1066
Diaz-Delgado, J., A.E. de los Monteros, C. Fernandez-Maldonado, M. Arbelo, O. Quesada-Canales, M. Andrada and A. Fernandez, 2012. Mixed testicular neoplasia in a short beaked common dolphin Delphinus delphis. Dis. Aquat. Organ, 101: 257-260
Estep, J.S., R.E. Baumgartner, F. Townsend, D.A. Pabst and W.A. McLellan et al., (2005) Malignant seminoma with metastasis, Sertoli cell tumor and pheochromocytoma in a spotted dolphin (Stenella frontalis) and malignant seminoma with metastasis in a bottlenose dolphin (Tursiops truncatus). Vet. Pathol., 42: 357-359
Diaz-Delgado, J., E. Sierra, M. Arbelo, A. Suarez-Bonnet, C. Suarez-Santana, E. Grau-Bassas & A. Fernandez (2015) Primary uterine T-cell Lymphoma with metastasis in an Atlantic spotted dolphin (Stenella frontalis), Canary islands, Spain. J. Wildl. Dis., 51: 538-841.
(Cetacean stranding in Mediterranean sea, p. 27)
Bermudez, L., M.F. van Bressem, O. Reyes-Jaimes, A.J. Sayegh and A.E. Paniz Mondolfi (2009) Lobomycosis in man and lobomycosis-like disease in bottlenose dolphin, Venezuela. Emerg. Infect. Dis., 15: 1301-1303
« Code de bonne conduite pour le whale watching », sur sanctuaire-pelagos.org, Parc national de Port-Cros, pour le Ministère français chargé de l’Environnement
Pamela M. Willis, Bernard J. Crespi, Lawrence M. Dill, Robin W. Baird et M B. Hanson, « Natural hybridization between Dall's porpoises (Phocoenoides dalli) and harbour porpoises (Phocoena phocoena) », Canadian Journal of Zoology, vol. 82, no 5, 1er mai 2004, p. 828-834 (résumé)
« Incroyable découverte d'un hybride de baleine à bosse et d’un rorqual », sur cetace.info
Baird R.W (2000). The killer whale: Foraging specializations and group hunting. Pages 127–153 in J. Mann, R. C. Connor, P. L. Tyack and H. Whitehead, eds. Cetacean societies: Field studies of dolphins and whales. University of Chicago Press, Chicago, IL
(en) Référence Animal Diversity Web : Stenella longirostris
« Les 13 baleines du Saint-Laurent »(Archive • Wikiwix • Archive.is • Google • Que faire ?), sur darwin.cyberscol.qc.ca (consulté en novembre 2008)
Caroline Lepage, « DRS: un poste à responsabilités chez les dauphins ! », sur futura-sciences.com, 14 septembre 2004
(DVD) La société des dauphins : Une solidarité à toute épreuve, Bertrand Loyer ASIN: B000F3AOOE
(en) Référence Animal Diversity Web : Stenella coeruleoalba
(en) Référence Animal Diversity Web : Eubalaena glacialis
Signature whistle shape conveys identity information to bottlenose dolphins. Janik VM, Sayigh LS, Wells RS. Proc Natl Acad Sci U S A. 2006 May 23;103(21):8293-7.
(en) Référence Animal Diversity Web : Delphinapterus leucas
« Une baleine témoin de la chasse du XIXe siècle », sur tempsreel.nouvelobs.com, juin 2007
(en) WA Watkins, M-A Daher, KM Fristrup, TJ Howald et G Notarbatolo Di Sciara, « Sperm whales tagged with transponders and tracked underwater by sonar. », Marine Mammal Science, vol. 9, 1993, p. 55-67 record répertorié dans (en) « SPERM WHALE », sur The penguiness book (consulté en novembre 2008)
(en) R Hobson et A Martin, « Behaviour and dive times of Arnoux's beaked whales, Berardius arnuxii, at narrow leads in fast ice. », Canadian Journal of Zoology, vol. 74, 1996, p. 388-393 record répertorié dans (en) « BEAKED WHALES », sur The penguiness book (consulté en novembre 2008)
« La migration des baleines à bosse dans l’océan Austral », sur recherche polaires, CNRS, 4 septembre 2008
« Plus de deux tiers des dauphins, des marsouins et autres espèces de la famille des cétacés sont en danger d’être abattus ou pris dans des filets »(Archive • Wikiwix • Archive.is • Google • Que faire ?), Salle de presse, Programme des Nations Unies pour l'environnement, novembre 2005
(en) Référence UICN : espèce Lipotes vexillifer Miller, 1918
(en) Référence UICN : espèce Phocoena sinus Norris et McFarland, 1958
(en) Référence UICN : espèce Balaenoptera borealis Lesson, 1828
(en) Référence UICN : espèce Balaenoptera musculus (Linnaeus, 1758)
(en) Référence UICN : espèce Balaenoptera physalus (Linnaeus 1758)
(en) Référence UICN : espèce Cephalorhynchus hectori (van Beneden, 1881)
(en) Référence UICN : espèce Eubalaena glacialis P.L.S. Müller, 1776
(en) Référence UICN : espèce Eubalaena japonica (Lacépède, 1818)
(en) Référence UICN : espèce Platanista gangetica (Roxburgh, 1801)
(en) Référence UICN : espèce Balaena mysticetus Linnaeus, 1758
Jensen, A. S., Silber, G. K., & Calambokidis, J. (2004). Large whale ship strike database. Washington, DC: US Department of Commerce, National Oceanic and Atmospheric Administration.
« Résumé et conclusions », La pêche aux filets dérivants et son impact sur les espèces non visées: étude mondiale, FAO
« la pêche illégale au filet dérivant », sur whaletrackers
MNHN, Incroyables cétacés ; Hommes-cétacés : des rapports ambigus ; Exposition, 11 juin 2008 → 25 mai 2009 ; Grande Galerie de l’Évolution
(en) « dispositifs anti collisions », sur http://www.souffleursdecume.com/index.html, 2013(consulté le 28 avril 2017)
(en) KA Stockin, D Lusseau, V Binedell et N Wiseman, « Tourism affects the behavioural budget of the common dolphin Delphinus sp. in the Hauraki Gulf, New Zealand », Marine Ecology Progress Series, vol. 355, 26 février 2008, p. 287–295 (ISSN 0171-8630 et 1616-1599, DOI 10.3354/meps07386, lire en ligne)
María Belén Argüelles, Mariano Coscarella, Ana Fazio et Marcelo Bertellotti, « Impact of whale-watching on the short-term behavior of Southern right whales (Eubalaena australis) in Patagonia, Argentina », Tourism Management Perspectives, vol. 18, 1er avril 2016, p. 118–124 (DOI 10.1016/j.tmp.2016.02.002, lire en ligne)
Nicole E. Filby, Karen A. Stockin et Carol Scarpaci, « Long-term responses of Burrunan dolphins (Tursiops australis) to swim-with dolphin tourism in Port Phillip Bay, Victoria, Australia: A population at risk », Global Ecology and Conservation, vol. 2, 1er décembre 2014, p. 62–71 (DOI 10.1016/j.gecco.2014.08.006, lire en ligne)
Lee Sang-Mog et Daniel Robineau, « The cetaceans of the Neolithic rock carvings of Bangu-dae (South Korea) and the beginning of whaling in the North-West Pacific. », L'Anthropologie, vol. 108, no 1, 2004, p. 137-151 (résumé)
- Portail des cétacés
- Portail des mammifères
Sv7bjr N8Ujq8MObkMxJkVuC,6PMv2H,pAHZj9EzA,le8002cI7SOLPg cf9sSc,6Y6x2Edhxv6 KLnK7A U5x b















